アストラゼネカのイミフィンジ、切除不能のステージIIIの非小細胞肺がんの全生存期間を顕著に延長 5年経過時点で生存している患者さんは43%にのぼる
本資料はアストラゼネカ英国本社が2021年6月4日に発信したプレスリリースを日本語に翻訳し、 みなさまのご参考に提供するものです。
本資料の正式言語は英語であり、 その内容・解釈については英語が優先します。
第III相PACIFIC試験の長期データがASCOで発表され33%の患者さんが5年経過した時点においても病勢進行せず
切除不能なステージIIIの非小細胞肺がんに対する免疫治療薬の第III相試験の中でこれまでで最も長い生存期間を示した
アストラゼネカ(本社:英国ケンブリッジ、 最高経営責任者(CEO):パスカル・ソリオ[Pascal Soriot])は、
第III相PACIFIC試験の最新データから、 イミフィンジ(R)(一般名:デュルバルマブ[遺伝子組換え]、 以下、 イミフィンジ)が、
同時化学放射線療法(CRT)後にがんが進行しなかった切除不能なステージIIIの非小細胞肺がん(NSCLC)の患者さんにおいて、
5年経過時点に持続的で臨床的に意義のある全生存期間(OS)および無増悪生存期間(PFS)の延長を示したことを発表しました。
肺がんは、 がんによる死因の第1位で、 すべてのがんによる死亡の約5分の1を占めており、 肺がん患者さんの80~85%がNSCLCです(1-3)。 また、
NSCLC患者さんの4人に1人が切除不能(手術で切除することができない)であるステージIIIと診断されます(4,5)。 PACIFIC試験の結果に基づいた、
切除不能なステージIIIのNSCLCにおけるイミフィンジの承認は、 この疾患の患者さんにとって数十年ぶりとなる新たな治療選択肢となりました(2,6,7)。
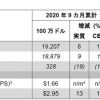
今回発表された最新の事後解析の結果において、 CRT後の患者さんの5年生存割合の推定値は、 イミフィンジ投与群で42.9%、 プラセボ投与群で33.4%であり、
OSの中央値は、 イミフィンジ投与群で47.5カ月、 プラセボ投与群では29.1カ月でした。 また、 最長1年間の治療を受けた患者さんにおいて、
試験開始から5年間がんが進行しなかった患者さんの割合はプラセボ投与群で19.0%であったのに対し、 イミフィンジ投与群では33.1%でした。 なお、
これらの結果は、 2017年と2018年に The New England Journal of Medicine(
https://www.nejm.org/doi/full/10.1056/NEJMoa1809697?query=featured_home
)誌に掲載された主要評価項目であるPFSおよびOSの追加解析に基づいています(8,9)。
PACIFIC試験の治験医師であり、 Sarah Cannon Research Instituteで最高科学責任者を務めるDavid Spigel
医師は次のように述べています。 「PACIFIC試験は切除不能なステージIIIの非小細胞肺がんの患者さんの治療において、 再び前例のない新たな結果を示しました。
これまでこれら患者さんの5年生存割合はわずか15~30%となっていましたが、 最新の試験結果から、 イミフィンジによる治療を最長1年間おこなうことで、
推定43%の患者さんが5年を経過した時点においても生存していることが示されました。 さらにはこれら患者さんの4分の3は病勢進行が認められず、 これは、
根治を目的とした切除不能なステージIIIの非小細胞肺がん治療における5年という節目の大きな成果であると言えます」。
アストラゼネカのエグゼクティブバイスプレジデント兼オンコロジービジネスユニットの責任者であるDave Fredricksonは次のように述べています。
「5年生存は、 臨床的に意義があるだけでなく、 がん患者さんとそのご家族にとっては感情の面においても重要な節目となります。 また、
治療を完了してから4年という長期間において、 生存している患者さんの大半が病勢進行していないことも驚くべき結果です。 これらの結果は、
ステージIIIの切除不能な肺がんでは初めて示された結果であり、
根治を目的としたこのステージの治療における標準治療として確立されたイミフィンジの長期的なベネフィットをさらに強化する結果です。 アストラゼネカは、
PACIFIC試験をはじめとする臨床試験や、 さまざまながん種の早期ステージにおける包括的な開発プログラムによって、
できるだけ早期に治療することでがんの転帰を改善することを戦略としており、 治癒の可能性を高め、 患者さんの人生を変える治療法を提供することを目指しています」。
第III相PACIFIC試験のOS主要解析において、 プラセボ投与群との比較でイミフィンジ投与群にみられた主な(発現率20%以上の)有害事象は、
咳嗽(イミフィンジ投与群35.2%対プラセボ投与群25.2%、 以下同様)、 倦怠感(24.0%対20.5%)、
呼吸困難(22.3%対23.9%)および放射線肺臓炎(20.2%対15.8%)でした。 CTCAEグレード3または4の有害事象の発現率は、
イミフィンジ投与群で30.5%、 プラセボ投与群で26.1%でした。 また有害事象により治療を中止した割合は、 イミフィンジ投与群で15.4%、
プラセボ投与群で9.8%でした。
これらの結果は、 2021年6月4日に行われた米国腫瘍学会(ASCO)にて発表されました。
イミフィンジは、 切除不能なステージIIIのNSCLCにおけるCRT後の根治を目的とした治療薬として、 米国、 日本、 中国、 欧州諸国をはじめ、
多くの国々で承認されています。 2018年2月に初めて承認されて以降、
80,000人以上の切除不能なステージIIIのNSCLC患者さんがイミフィンジによる治療を受けています。
アストラゼネカは、 イミフィンジにおいて治癒の可能性がある肺がんの早期ステージを含めた複数の第III相試験(PACIFIC-2、 PACIFIC-4、
PACIFIC-5、 MERMAID-1、 MERMAID-2、 AEGEAN、 ADJUVANT BR.31、 ADRIATIC)を実施しています。 また、
イミフィンジと新薬候補との併用療法を評価する試験として、
ステージIIIの切除不能(COAST)および早期ステージの術前補助療法(NeoCOAST)を対象とした2つの第II相試験も進行中です。
以上
*****
ステージIIIのNSCLCについて
2020年には、 全世界で推定220万人が肺がんと診断されました(1)。 肺がんはNSCLCと小細胞肺がん(SCLC)に大別され、
肺がん患者さんの80~85%がNSCLCに分類されます(2,3,5)。 ステージIIIのNSCLCはNSCLC全体のおよそ4分の1を占めます(4)。
ステージIII(局所進行性)のNSCLCは、 一般的に、 局所的にどの程度がんが拡がっているかによって定義される3つのサブカテゴリー(IIIA、
IIIBおよびIIIC)に分類されます。 ステージIIIの病変は、 がんが拡がっている(転移している)ステージIVの病変とは異なるため、
ステージIIIの患者さんの大半は根治目的の治療を行います(5,10)。
PACIFIC試験について
PACIFIC試験は、 PD-L1の状態にかかわらず、
白金製剤を用いた同時化学放射線療法後に増悪が認められなかった切除不能局所進行(ステージIII)非小細胞肺がん(NSCLC)患者さんを対象にイミフィンジを投与した、
無作為化二重盲検プラセボ対照多施設国際共同試験です。
本試験は、 713名の患者さんを対象に、 26カ国235施設で実施されました。 主要評価項目はPFSおよびOSであり、
副次評価項目はランドマークPFSおよびOS、 客観的奏効率および奏効期間が含まれました。
イミフィンジについて
イミフィンジ(デュルバルマブ[遺伝子組換え])はヒトPD-L1に結合するヒトモノクローナル抗体であり、
PD-L1に結合しPD-L1とその受容体であるPD-1およびCD80の相互作用を阻害することで、 腫瘍の免疫逃避機構を抑制し抗腫瘍免疫反応を誘発します。
イミフィンジは、 切除不能なステージIIIのNSCLCに対する承認に加え、
第III相CASPIAN試験に基づき進展型小細胞肺がん(ES-SCLC)の治療薬として、 米国、 欧州、 日本およびその他の多くの国々で承認されています。
また、 前治療歴のある進行膀胱がん患者さんの治療薬としても複数の国で承認されています。
広範な開発プログラムの一環として、 イミフィンジは、 NSCLC、 SCLC、 膀胱がん、 肝細胞がん、 胆道がん(肝がんの一種)、 食道がん、 胃がん、
子宮頸がん、 卵巣がん、 子宮内膜がん、 その他の固形がんの治療として、 単独療法ならびに併用療法においても検討されています。
肺がん領域におけるアストラゼネカについて
アストラゼネカは、 疾患の早期発見と早期治療を通じて、 肺がん患者さんを根治に導く治療を提供するとともに、
治療耐性や病勢進行した状況においても効果が期待できる治療法を追求すべくサイエンスの限界に挑戦し続けていきます。 また、
新たな治療ターゲットとアプローチを定義することで、 患者さんにとって最も高い治療効果が期待できる医薬品を特定し、 提供していくことを目指しています。
当社の包括的なポートフォリオには、 革新的な肺がん治療薬であるタグリッソ(R)(オシメルチニブ)、 イレッサ(R)(ゲフィチニブ)、
免疫チェックポイント阻害剤であるイミフィンジ(デュルバルマブ)およびトレメリムマブや第一三共と共同開発を進めているエンハーツおよびdatopotamab
deruxtecan、 HUTCHMEDと共同開発を進めているサボリニチブなど、
新薬候補となる開発品および多様な作用機序を組み合わせた開発パイプラインが含まれます。
アストラゼネカはLung Ambition Alliance(LAA)の創設メンバーであり、 LAAは、 イノベーションを促進し、 肺がん患者さんの治療を含め、
治療を超えた人々に意味のある改善を提供するために取り組んでいます。
アストラゼネカの免疫腫瘍学(IO)への取り組み
免疫腫瘍学(IO)はヒトの免疫システムを刺激し腫瘍を破壊するよう設計された治療アプローチです。 アストラゼネカにおけるIOポートフォリオは、
抗腫瘍免疫抑制を克服するよう設計された免疫治療によって支えられています。 当社は、 がん種を問わず、 より多くのがん患者さんの長期的な生存に貢献するべく、
IOに基づく治療アプローチに投資をしています。
また、 イミフィンジの単剤療法およびトレメリムマブやその他新規抗体薬との併用療法に対しては、 様々ながん種、 病期、 治療ラインにおいて、
また必要に応じて患者さんにとって最善となる治療の方向性を定義する決定ツールとしてPD-L1バイオマーカーを用いる場面において、
包括的な臨床試験プログラムが進行中です。 さらに、
当社のIOポートフォリオを当社オンコロジー全パイプラインあるいはパートナーの標的低分子化合物の中から広く併用療法を検討していくことにより、
広範な腫瘍に対する新たな治療選択肢を提供できる可能性があります。
アストラゼネカにおけるオンコロジー領域について
アストラゼネカは、 あらゆる種類のがんに対して治療法を提供するという高い目標を掲げ、 がんとその発見にいたるまでの複雑さを科学に基づいて理解し、
患者さんの人生を変革する医薬品の開発および提供を通じて、 オンコロジー領域の変革をけん引していきます。
アストラゼネカは治療困難ながん種に注力しています。 当社は持続的なイノベーションにより、 医療活動および患者さんの医療経験を一変させる可能性のある、
製薬業界でもっとも多様なポートフォリオと開発パイプラインを構築しています。
アストラゼネカはがん治療のパラダイムを再定義し、 将来的にはがんによる死亡をなくすことをビジョンに掲げています。
アストラゼネカについて
アストラゼネカは、 サイエンス志向のグローバルなバイオ・医薬品企業であり、 オンコロジーおよび循環器・腎・代謝疾患、
呼吸器・免疫疾患からなるバイオ・医薬品において、 医療用医薬品の創薬、 開発、 製造およびマーケティング・営業活動に従事しています。
英国ケンブリッジを本拠地として、 当社は100カ国以上で事業を展開しており、 その革新的な医薬品は世界中で多くの患者さんに使用されています。 詳細については
https://www.astrazeneca.comまたは、 ツイッター @AstraZeneca
(
https://twitter.com/AstraZeneca
)(英語のみ)をフォローしてご覧ください。
References
1. World Health Organization. International Agency for Research on Cancer. Lung
Fact Sheet. Available at
https://gco.iarc.fr/today/data/factsheets/cancers/15-Lung-fact-sheet.pdf.
Accessed May 2021.
2. Cheema PK, et al. Perspectives on Treatment Advances for Stage III Locally
Advanced Unresectable Non-Small-Cell Lung Cancer. Curr Oncol. 2019;26(1):37–42.
3. LUNGevity Foundation. Types of Lung Cancer. Available at
https://lungevity.org/for-patients-caregivers/lung-cancer-101/types-of-lung-cancer
. Accessed May 2021.
4. EpiCast Report: NSCLC Epidemiology Forecast to 2025. GlobalData. 2016.
5. Provencio M, et al. Inoperable Stage III Non-Small Cell Lung Cancer: Current
Treatment and Role Of Vinorelbine. J Thorac Dis. 2011;3:197-204.
6. Curran WJ, et al. Sequential vs Concurrent Chemoradiation for Stage III
Non–Small Cell Lung Cancer: Randomized Phase III Trial RTOG 9410. J Natl Cancer
Inst. 2011;103(19):1452-1460.
7. Hanna N, et al. Current Standards and Clinical Trials in Systemic Therapy for
Stage III Lung Cancer: What is New? Am Soc Clin Oncol Educ Book. 2015:e442-447.
8. Anthonia SJ et al. Durvalumab after Chemoradiotherapy in Stage III
Non-Small-Cell Lung Cancer. N Engl J Med. 2017;377:1919-1929.
9. Antonia SJ, et al. Overall Survival with Durvalumab after Chemoradiotherapy
in Stage III NSCLC. N Engl J Med. 2018;379:2342-2350.
10. ASCO. Cancer.net. Lung Cancer – Non-Small Cell. Available at
https://www.cancer.net/cancer-types/lung-cancer/view-all. Accessed May 2021.
プレスリリースは以下よりダウンロードできます。
https://prtimes.jp/a/?f=c-24308-2021061111-c9f074beaccc3a7e782fceb113d882f7.pdf
当リリースの詳細について
https://prtimes.jp/main/html/rd/p/000000318.000024308.html
※このメールは自動送信されていますので、返信はご遠慮ください。

https://prtimes.jp この企業からのメール配信停止
[]
| 全メール配信停止
[]
| HTMLメール配信停止
[]
発行:株式会社PR TIMES []
Copyright (c) PR TIMES Inc. All Rights Reserved.
[https://www.google-analytics.com/collect?v=1&tid=UA-5469649-15&cid=000000318.000024308&dp=/main/html/rd/p/000000318.000024308.html&dt=アストラゼネカのイミフィンジ、切除不能のステージIIIの非小細胞肺がんの全生存期間を顕著に延長 5年経過時点で生存している患者さんは43%にのぼる&el=2021.06.11&t=event&ec=email&ea=open





ディスカッション
コメント一覧
まだ、コメントがありません