高時間分解能解析により膵β細胞新生の新たな特徴が明らかに
糖尿病再生医療への応用に期待 ~ 順天堂大学大学院医学研究科代謝内分泌内科学の宮塚 健客員教授(現北里大学医学部内分泌代謝内科学教授)、 綿田裕孝教授、
大阪大学大学院医学系研究科糖尿病病態医療学寄附講座の佐々木周伍特任研究員、 同内分泌・代謝内科学の下村伊一郎教授、 ブリティッシュコロンビア大学のFrancis
Lynn准教授らの共同研究グループは、 インスリン産生細胞である膵β 細胞(*1)のうち、 内分泌前駆細胞から分化したばかりの新生β
細胞を時間軸に沿って詳細に解析できるマウスモデルを確立し、 新生β 細胞の発生場所や遺伝学的な特徴を高解像度で解析することに成功しました。 本成果は新たな膵β
細胞作製法の開発につながる可能性があり、 糖尿病根治に向けた治療法開発への応用が期待されます。
本論文は欧州糖尿病学会雑誌Diabetologia誌に2022年3月30日付で公開されました。 なお、 本研究の膵β
細胞の蛍光顕微鏡画像が該当号の表紙に採用されました。 本研究成果のポイント * 新生β細胞を時間軸に沿って詳細に解析できるマウスを作製
* 新生β細胞の生まれる場所を特定し、 遺伝子発現プロファイルを解明
* 膵β細胞作製による糖尿病再生医療の実現に向けた新規治療法の開発へ
背景
糖尿病は膵β 細胞から分泌されるインスリンの相対的・絶対的不足により発症します。 そのため糖尿病の根治を実現するためには失われたインスリン分泌を補う必要があり、
インスリンを産生する膵β 細胞を補充する糖尿病再生医療が注目されています。 この実現に向けた一つの手がかりは、 「膵β
細胞がいつ・どこで・どのようにして生まれるのか?」 を明らかにすることにあります。 膵β
細胞は胎生期膵臓内にある膵管領域に存在する内分泌前駆細胞に由来することが知られていましたが、 正確にどこから生まれ、 どのような遺伝子がβ
細胞新生を規定しているのか不明でした。 本研究では生まれたばかりのβ 細胞を高時間分解能(*2)で標識できるマウスを作製し、 その位置情報を解析するとともに、
シングルセルRNAシークエンシング(scRNA-seq)*3を用いて新生β 細胞の特徴を高解像度で解明することを目的としました。 また、 ヒトのβ
細胞新生過程に特徴的な遺伝子情報を明らかにすることを目的に、 ヒトES細胞由来β 細胞とマウス新生β 細胞との類似性・相違性を解析しました。
内容
本研究では、 まず、 β細胞新生の位置情報を高解像度で解析するために、 新生β細胞を蛍光蛋白質で識別する“Ins1-GFP;Timerマウス”を確立しました。
このマウスの胎生期膵組織を顕微鏡で観察したところ、 以前から予想されていた膵管近傍で生まれる新生β細胞(βduct)の存在を確認し、 加えて、
血管近傍で生まれる新生β細胞(βvessel)を同定しました。 本研究の結果は、
膵β細胞の新生経路が2つ存在すること(空間的不均質性)を世界で初めて明らかにしました(図1左)。図1:新生β細胞の空間的不均質性および遺伝子発現プロファイルの不均質性
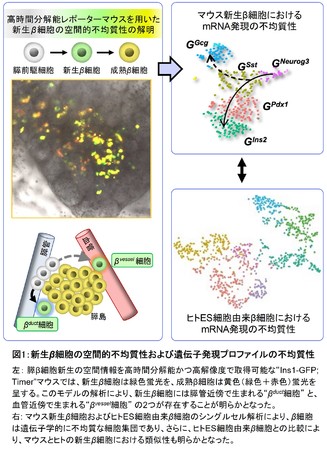
図1:新生β細胞の空間的不均質性および遺伝子発現プロファイルの不均質性
次に、 新生β細胞のmRNA情報を明らかにするため、 新生β細胞のscRNA-seqを行いました。 scRNA-seqの無作為的な解析によって、
新生β細胞は5つの異なる細胞集団で形成されることが判明しました(図1右上)。 scRNA-seqおよび組織学的検討によって、
βduct細胞にはグルカゴン陽性・MafB陽性というより未熟な特徴を持つ細胞が多く、
βvessel細胞はMafA陽性細胞が多く含まれることが明らかになりました。 さらに擬時系列解析によって、 β 細胞はNeurog3(*4)陽性新生β
細胞からソマトスタチン陽性細胞を経由して分化することを見出しました。
さらに、 マウスとヒトの新生β 細胞の特徴を比較するため、 ヒトES細胞からin vitroで分化誘導した膵β
様細胞(ヒト新生β細胞分画を含む)のscRNA-seq解析を行いました。 その結果、
ヒトES細胞由来のインスリン産生細胞においてもソマトスタチンが高発現していることが分かり、 マウスとヒトで共通する新規のβ
細胞新生経路の存在が明らかとなりました(図1右下)。
このように、 β 細胞の新生過程を高時間分解能で解析するマウスモデルを確立したことにより、 β
細胞の生まれる場所(微小環境)や遺伝子発現プロファイルの特徴を解明することに成功しました。
今後の展開
近年、 ES細胞やiPS細胞からインスリン産生細胞を作製できるようになりましたが、 我々の体に内在する膵β細胞と比較して、
質的にも量的にも不十分であることが大きな課題となっています。
今回の研究成果はこれまで区別不可能であった新生β細胞と成熟β細胞を区別しながら解析することに成功しただけでなく、 新生β細胞の特長を1細胞レベルで解明し、
さらにβ細胞を取り巻くニッチ(発生に必要な微小環境)の特徴を明らかにしました。 本知見を応用することにより、
より効率的かつ安全な膵β細胞作製法への応用が期待されます。 現在、 糖尿病根治に向けた新たなβ細胞誘導法の開発に取り組んでいます。
用語解説
*1 膵β細胞: 血糖値を下げるホルモンであるインスリンを分泌する細胞。 糖尿病患者ではβ細胞の機能が低下、 あるいはβ細胞数が減少している。
*2 高時間分解能:2つの細胞を時間軸に沿って詳細に識別する能力のこと。 β細胞の解析においては、
従来法では内分泌前駆細胞から分化したばかりのβ細胞と成熟したβ細胞を区別する方法がなかった。
本研究では内分泌前駆細胞から分化したばかり(8時間以内)のβ細胞を標識することに成功した。
*3 シングルセルRNAシークエンシング: 1細胞レベルでRNA発現量を解析できる最新技術。
*4 Neurog3: 膵内分泌細胞および腸管内分泌細胞の分化に不可欠な転写因子。
原著論文
本研究は欧州糖尿病学会雑誌Diabetologia誌で(2022年3月30日付)公開されました。
タイトル: Spatial and transcriptional heterogeneity of pancreatic beta cell
neogenesis revealed by a time-resolved reporter system
タイトル(日本語訳):高時間分解能レポーターシステムによって明らかとなった膵β細胞新生の空間的不均質性および遺伝子発現プロファイルの不均質性
著者:Shugo Sasaki1, 2, 3, 4, Michelle Y. Y. Lee3, Yuka Wakabayashi5, Luka Suzuki5,
Helena Winata3, Miwa Himuro5, Taka-aki Matsuoka1, Iichiro Shimomura1, Hirotaka
Watada5, 6, Francis C. Lynn3, 4, Takeshi Miyatsuka5, 6, 7
著者(日本語表記): 佐々木周伍1, 2, 3, 4, Michelle Y. Y. Lee3, 若林侑香5, 鈴木路可5, Helena Winata3,
氷室美和5, 松岡孝昭1, 下村伊一郎1, 綿田裕孝5, 6, Francis C. Lynn3, 4, 宮塚 健5, 6, 7
著者所属:1)大阪大学大学院医学系研究科内分泌・代謝内科学、 2)大阪大学大学院医学系研究科糖尿病病態医療学寄附講座、
3)ブリティッシュコロンビア小児病院研究所、 4)ブリティッシュコロンビア大学外科、 5)順天堂大学大学院医学研究科代謝内分泌内科学、
6)順天堂大学大学院医学研究科糖尿病治療標的探索医学講座、 7)北里大学医学部内分泌代謝内科学
DOI: 10.1007/s00125-022-05662-0
※本研究の膵β 細胞の蛍光顕微鏡画像が該当号の表紙に採用されました。 (URL:
https://link.springer.com/journal/125/volumes-and-issues/65-5)
本研究はJSPS科研費(JP16K09766, JP19H04060)、 武田科学振興財団、 鈴木謙三記念医科学応用研究財団、 アステラス病態代謝研究会、
イーライ・リリー財団、 Canadian Institutes of Health Research (FRN 156377)、 Michael Smith
Foundation for Health Research (No. #5238 BIOM)、 BC小児病院研究所、 鈴木万平糖尿病財団、 Juvenile
Diabetes Research Foundationの支援を受け多施設との共同研究の基に実施されました。 なお、
本研究にご協力いただいた皆様には深謝いたします。




ディスカッション
コメント一覧
まだ、コメントがありません