MACがNET形成を誘導することで肺の組織障害を引き起こすことを発見
MACがNET形成を誘導することで肺の組織障害を引き起こすことを発見 ~ 重症化因子の特定・創薬への可能性 ~
順天堂大学大学院医学研究科呼吸器内科学の大学院生の中村洸太、 医療看護学部/大学院医学研究科環境医学研究所の岩渕和久教授、 中山仁志准教授の共同研究グループは、
肺MAC症の原因菌であるM. aviumやM. intracellulareが、 好中球にNET形成(*1)を誘導し、
肺の組織障害を引き起こすMMPs(*2)の放出を促進していることを解明しました。 さらに、 従来は殺菌に寄与すると考えられているNET形成が、
MACの殺菌に寄与していないこと、 MACが好中球の走化活性因子であるIL-8の産生を誘導することで、
さらなる感染部位への好中球の集積を促すことがわかりました。 本成果は肺MAC症が重症化し呼吸不全に至る病態の解明、 ならびに、
抗菌薬以外の機序の新規治療方法の開発につながる可能性があります。 本論文はScientific
reports誌のオンライン版に2022年4月11日付で公開されました。 本研究成果のポイント * MACは好中球にNET形成させるとともに、
肺組織障害を引き起こすMMPsの放出を誘導する
* MACは好中球やNETsによる殺菌から逃れる
*
MACは好中球の走化活性因子であるIL-8の産生を誘導することで感染部位への好中球の集積を促し、 さらなる炎症と組織障害を引き起こす
背景
肺MAC症は日本や世界で罹患率・死亡者数が増加している疾患であり、 日本においては2014年にその罹患率が14.7人/10万人となって肺結核のそれを越えました。
M. aviumやM. intracellulare(図1、 MAC)は主に肺に感染し、 軽快と増悪を繰り返して徐々に進行し、 肺の組織障害を引き起こします。
経過の個人差が大きく、 無治療でもほとんど進行しない症例がある一方、 治療を行っても呼吸不全に至り、 持続的な酸素投与が必要となる症例も存在し、
時には死に至る場合もあります。 好中球はMAC感染の免疫応答にかかわる中心的な細胞の一つであり、 貪食、 脱顆粒、
NET形成(*2)などの機能により敵対する微生物を排除します。 肺MAC症において病変部位の主な細胞が好中球である患者は、
重症度がより高いことがわかっていますが、 その仕組みはわかっていませんでした。図1 抗酸菌の分類
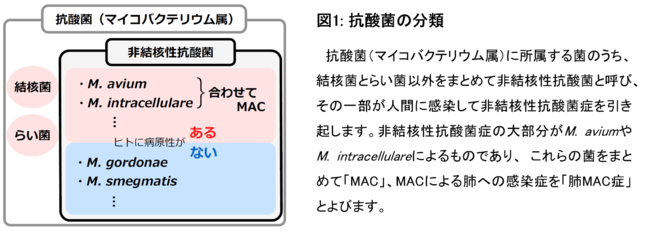
図1 抗酸菌の分類
長いDNA分子は通常、 ヒストンに折りたたまれた状態で核内に存在しています。
一旦NET形成がおきるとヒストンがシトルリン化(*3)されることによりDNAとヒストンの結合が緩み、 細胞内の抗菌タンパク質などとともに細胞外へ放出されます。
NETs(*1)には抗菌タンパク質の作用による殺菌効果があります。 そのため、 過度の好中球の集積によって炎症や周囲の組織障害を引き起こすことがあります。
また、 場合によってはヒストンにDNAが含まれていることから、 好中球と自己免疫疾患との関連が報告されています。
本研究ではMACが引き起こす肺組織障害の機序を解明することを目的として、 MACとNET形成の関係性を調べました。
内容
本研究では、 健常人から採血した血液から分離したヒト好中球をMACで刺激し、 非病原性抗酸菌(ヒトへ感染することがほとんどないM. gordonaeやM.
smegmatis:図1)と比較することでMACとNET形成の関係性を評価しました。 MACがNET形成を誘導することを確認するために、
シトルリン化されたヒストンの免疫蛍光染色やDNAの染色を行い、 共焦点顕微鏡で観察を行ったところ、 MACによるNET形成の促進が明らかになりました。 加えて、
細胞外へ放出されたMMPsなどの酵素をELISA法を用いて解析したところ、 MACはMMP-8やMMP-9などの放出を誘導し、
またこれらはNET形成を介して促進されていることが判明しました。 このMMP-8やMMP-9は、 肺を構成するコラーゲンを分解することができ、
空洞形成や気管支拡張などの肺の組織障害を引き起こすことが報告されています。 これらのことは、 NET形成に促進されたMMPs放出が、
肺MAC症の組織障害を引き起こすことを示唆しています。
殺菌率の評価では、 非病原性抗酸菌が好中球によって効率的に殺菌されるのに対し、 MACは好中球による殺菌を抑制していました。 また、
従来は殺菌に寄与するはずのNET形成が好中球によるMACの殺菌には関与しないこと、
そしてMACは好中球の走化活性因子であるIL-8の産生も誘導することが判明しました。 効率的な殺菌が行われないにもかかわらず、
IL-8の作用により感染部位へ好中球がさらに集まってくることは、 NET形成を含む好中球性の炎症と組織障害が慢性的に持続していくことに繋がります(図2)。図2 本研究で明らかになった肺MAC症でのNET形成による組織障害のメカニズム

図2 本研究で明らかになった肺MAC症でのNET形成による組織障害のメカニズム
上記の実験では、 肺MAC症患者から分離されたMAC菌株を複数使用しており、 中には重症の方も軽症の方も含まれていましたが、
それでもNET形成やMMPsの放出、 IL-8の産生には有意な差はありませんでした。 このことは、 MACによる肺組織障害の重症度には、
MACの菌株ごとの毒性の差よりも患者個人が持っているなんらかの因子の差が大きく影響していることを示唆しています。 加えて、
MMPsは不活性型の前駆体で放出されることから、 肺でのMMPの活性化機構(*1)が、 患者の病態の違いに関係している可能性があります。
今後の展開
今回、 MACは好中球にNET形成を誘導する一方、 NETsによる殺菌を回避し、 逆にNET形成を利用してMMPsの放出を誘導するとともに、
IL-8の産生を促すことで好中球の集積とNET形成を促進すると考えられました(図2)。 これらの結果は、
MACが好中球を利用して肺への感染と組織障害を引き起こしている可能性を示しているため、
好中球のNET形成はMAC感染症に対する新たな治療のターゲットと考えられます。 今後、
MACによる好中球NET形成促進の分子機構がさらに解明されることによって、
肺MAC症の重症化にかかわるメカニズムの解明や抗菌薬とは異なる機序の治療方法の開発につながると考えています。
用語解説
*1 MMPs(Matrix metalloproteinases/マトリックスメタロプロテアーゼ):
マトリックスメタロプロテアーゼは、 臓器を構成する組織の構造を支えるために必要なコラーゲンなどの細胞外マトリックスを分解することができる酵素です。
コラーゲンの分解以外にも細胞の表面に発現するタンパク質の分解、 酵素の活性化など、 役割は多岐にわたります。 好中球では、
MMP-8とMMP-9が好中球の顆粒という袋の様なものの中に、 不活性型の前駆体として貯蔵されています。 これらMMPsは不活性型で細胞外に放出され、
感染・炎症部位で宿主由来のタンパク分解酵素によって活性化されると、 細胞外マトリックスタンパク質を分解して組織を壊します。
*2 NET形成/NETs (Neutrophils extracellular trap)
「NETs」は、 網状に張り巡らされたDNA繊維にヒストンや好中球顆粒タンパク質が絡んだ形状をしており、
感染などにより活性化した好中球が「NETs」を細胞外へ放出する一連の流れを「NET形成」とよびます。 感染防御に重要な役割を担う一方で、
蛋白分解酵素や抗菌ペプチドなどの顆粒成分が「NETs」と共に放出されて、 自身の正常な細胞も傷つけてしまうことで、 周囲の組織障害を引き起こす可能性があります。
*3 シトルリン化
塩基性のアルギニンが中性のシトルリンに置き換わる事を指します。 ヒストンがシトルリン化されるとDNAとの結合が不安定となり、 長いDNA分子がほどけていきます。
ヒストンのシトルリン化は、 NET形成における重要なイベントの一つであると考えられています。
原著論文
本研究はScientific report 誌のオンライン版で(2022年4月11日付)先行公開されました。
タイトル: Mycobacterium avium-intracellulare complex promote release of
pro-inflammatory enzymes matrix metalloproteinases by inducing neutrophil
extracellular trap formation.
タイトル(日本語訳): Mycobacterium avium-intracellulareは、 好中球のNET形成を誘導することにより、
炎症性酵素であるマトリックスメタロプロテアーゼの放出を促進する
著者:Kota Nakamura 1), Hitoshi Nakayama 2,3), Shinichi Sasaki 1), Kazuhisa
Takahashi 1), Kazuhisa Iwabuchi 2,3)
著者(日本語表記): 中村洸太1)、 中山仁志2,3)、 佐々木信一1)、 高橋和久1)、 岩渕和久2,3)
著者所属:1)順天堂大学呼吸器内科学講座、 2) 順天堂大学大学院医学研究科環境医学研究所 3) 順天堂大学大学院医療看護学研究科感染制御看護学分野
DOI: 10.1038/s41598-022-09017-y
本研究はJSPS科研費JP17K10031, JP21K06086、 文部科学省私立大学戦略的研究基盤形成事業、
および革新的先端研究開発支援事業(AMED-CREST) 20ae0101068h0005の支援により実施されました。






ディスカッション
コメント一覧
まだ、コメントがありません