「てこ」と「ドミノ倒し」で巧妙に開くイオンの経路
―新規不整脈治療薬へ向けた手がかりを提示― 京都大学大学院薬学研究科 小川治夫 准教授、 順天堂大学大学院医学研究科 小林琢也 助教、 呉林なごみ
同客員准教授、 児玉昌美 同非常勤助教、 村山尚 同先任准教授らのグループは東京大学と共同で、
最先端の「クライオ電子顕微鏡(*1)による単粒子解析」と「定量的な機能解析」を組み合わせることにより、
心臓の超巨大カルシウムイオンチャネル(*2)である「2型リアノジン受容体(RyR2)*3」が開口する分子メカニズムを明らかにしました。
RyR2は心収縮の引き金となるカルシウムイオンを筋小胞体(*4)から放出するイオンチャネルで、 その遺伝子変異(300箇所以上)は不整脈疾患の原因となります。
そのため、 開口メカニズムの解明は科学的・医学的にも大きな意味を持ちます。 研究グループは、
極小分子であるカルシウムイオンが「てこ」と「ドミノ倒し」を巧みに組み合わせ、 自身の約6万倍もの大きさのRyR2のイオンの通り道を開くことを明らかにしました。
本研究成果は不整脈疾患に対する全く新しい診断法、 治療薬や予防薬の開発に貢献すると期待されます。
本研究成果は、 2022年5月20日に英国科学雑誌「Nature Communications」にオンライン掲載されました。図1
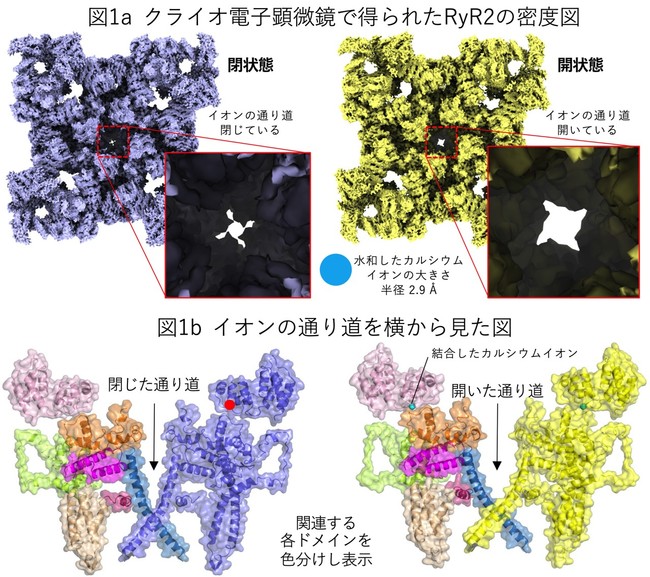
図1
1.背景
2型リアノジン受容体(RyR2)は、 心筋の筋小胞体に局在する超巨大な小胞体カルシウムイオンチャネルです。
活動電位によって細胞外から流入したカルシウムイオンがRyR2に結合することでRyR2が開口し、
筋小胞体に蓄えられたカルシウムイオンが瞬時に大量に放出され心筋の収縮が起こります。
RyR2の遺伝子変異(300箇所以上)はさまざまな不整脈疾患の原因としても知られており、 RyR2は不整脈疾患の標的分子としても注目を集めています。 しかし、
「カルシウムイオンのような小さな分子が、 一体どのように6万倍も大きな超巨大分子RyR2を制御しイオンを通す穴を開くか?」という点については謎のままでした。
そのため、 RyR2を原因とする不整脈疾患の効果的な診断や、 治療のための創薬への展開は困難を極めていました。 この疑問に答えるためには、
チャネルが「閉じた」状態と「開いた」状態の精密な立体構造の解明が必要です。 そして、
閉じた状態から開いた状態へ「どのように構造変化が起こるのか」を予測して検証する必要がありました。
2.研究手法・成果
高精度のタンパク質立体構造解析には純度の高いタンパク質が大量に必要ですが、 生体の心筋から直接RyR2を高純度で大量に精製することは極めて困難でした。
そこでヒト由来の培養細胞を用いてRyR2を大量に発現させ、 精製することでその課題を克服しました。
この標本を東京大学医学部設置のクライオ電子顕微鏡で解析することにより、
RyR2の閉じた状態(カルシウムイオン無し)と開いた状態(カルシウムイオン有り)の構造を3.2 Å分解能(*5)で決定することに成功しました(図1a)。
これは構成するアミノ酸側鎖を正確に決定可能な高い分解能です。 両者の構造を詳細に調べたところ、 超巨大な分子内に色分けをしたドメイン*6(図1b)があり、
それらがカルシウムイオン結合に伴い、 「ドミノ倒し」をするように次々と動くことが判明し(図2左)、
要所要所にはドミノ倒しが自然に起こらないようなストッパーがあることも予測されました。 また、 カルシウムイオンはCTDドメインの左端近傍に結合しますが、
それに伴いCTDは時計回りの回転運動を起こすことも判明しました(図2右)。 回転軸はカルシウムイオン結合部位のごく近傍にあり、
イオンの通り道を制御するS6ドメインは回転軸から遠く離れたCTDの右端に接続していることから、
カルシウムイオン結合部位での僅かな動きが「てこ」によりS6での大きな動きへ変換されることがわかりました(図2右)。図2
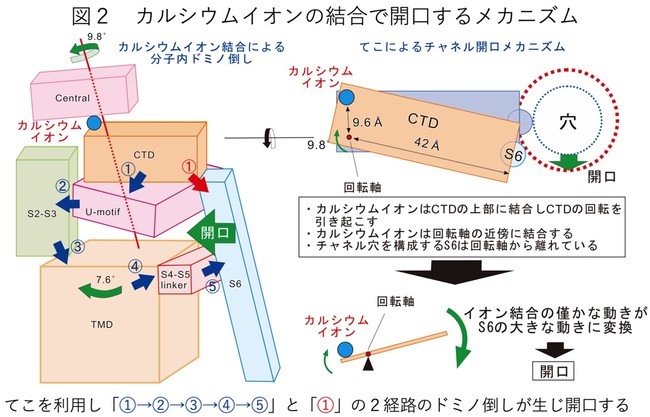
図2
以上の結果から予測されたRyR2の開口動作の検証のために、 一連の構造変化に重要と考えられるアミノ酸残基に変異を加えた変異体を42種類作製し、
定量的な機能解析を行いました。 その結果、 「ドミノ倒し」に関連する部分を破壊した変異体では機能欠損を、
ストッパーに関連する部分を破壊した変異体では機能亢進が生じることを見出しました。 さらに、
「ドミノ倒し」が途中で停止するように意図的に作成した機能欠損変異体の立体構造の解析を行いました。 その構造は予想通りカルシウムイオンが結合するものの、
構造変化が途中で停止していました。 以上の一連の結果は、 予測したメカニズムが正しいことを証明するものであり、
本研究によりRyR2がカルシウムイオンの結合で開口するメカニズムを世界で初めて解明することに成功しました。
3.波及効果、 今後の予定
RyR2の遺伝子変異を原因とする不整脈疾患に対して、 根本的な治療薬はこれまでに存在しませんでした。 本研究により、
機能欠損型には「ドミノ倒し」を生じやすくする化合物を、 機能亢進型には「ドミノ倒し」を弱める化合物を設計すればよいことが明らかとなりました。
ドミノ倒しが起こる部位は分かっていることから、 薬物の分子設計が可能になります。 また、
疾患変異の部位からそのタイプ(機能欠損型もしくは機能亢進型)を予測することが可能になり、 治療方針を決める1つの基礎となることが期待されます。 今後、
機能亢進型の立体構造も合わせて解明されることで、 さらにRyR2の動作原理に迫ることが期待されます。
4.研究プロジェクトについて
本研究は日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業(JP20am0101080、 JP19am0101115 (support
number 0064)、 JSPS科研費(19K07105、 19H03404、 JP16H04748、 21H02411)、 国立精神・神経医療研究センター
精神・神経疾患研究開発費(2-5)、 公益財団法人車競技公益資金記念財団(6114、 6237)等の支援を受けて実施されました。
<用語解説>
*1 クライオ電子顕微鏡:生体高分子をガラス上の氷に包埋した試料を極低温下に保ち電子顕微鏡写真を撮影し、 構造解析することができる。
タンパク質試料を結晶化する必要がなく、 高分解能でのタンパク質立体構造解析の手法に広く用いられている。
*2 イオンチャネル:生体膜上に存在するイオンを濃度勾配に従って透過させる役割を持つ膜タンパク質。
*3 2型リアノジン受容体(RyR2):心筋筋小胞体のカルシウムイオンチャネル。 心筋の収縮に必要なカルシウムイオンを細胞質へ遊離する。
*4 筋小胞体:筋細胞の小胞体。 筋収縮時に必要な細胞内カルシウムイオンを貯蔵する役割を持つ。
*5 3.2Å分解能:分離して観察できる距離が3.2Å。 Å(オングストローム)は長さの単位で、 1 mmの1,000万分の1。
*6 ドメイン:タンパク質のポリペプチド鎖の領域で、 コンパクトに折りたたまれた3次元構造を形成する。
<論文タイトルと著者>
タイトル:Molecular basis for gating of cardiac ryanodine receptor explains the
mechanisms for gain- and loss-of function
mutations(心筋リアノジン受容体の開口機構の分子基盤解明による機能亢進/欠損変異メカニズム)
著者:Takuya Kobayashi1)*, Akihisa Tsutsumi2)*, Nagomi Kurebayashi1), Kei Saito3),
Masami Kodama1), Takashi Sakurai1), Masahide Kikkawa2), Takashi Murayama1)# and
Haruo Ogawa4)# (*co-first author; #co-correspondence)
著者(日本語表記):小林 琢也1)*、 包 明久2)*、 呉林 なごみ1)、 斎藤 慧3)、 児玉 昌美1)、 櫻井 隆1)、 吉川 雅英2)、 村山
尚1)#、 小川 治夫4)#(*共同第一著者;#共同責任著者)
著者所属:1)順天堂大学大学院医学研究科 2)東京大学大学院医学系研究科 3)東京大学大学院総合文化研究科4)京都大学大学院薬学研究科
掲載誌:Nature Communications
DOI:10.1038/s41467-022-30429-x






ディスカッション
コメント一覧
まだ、コメントがありません