藻類細胞のサイズや成分含量の変化を電気で同時に高速測定できる装置を開発特定のユーグレナ株の選抜も可能なマイクロ流体デバイス
二酸化炭素から物質生産する藻類産業の加速に期待 【概要】
奈良先端科学技術大学院大学(学長:塩崎 一裕)先端科学技術研究科 物質創成科学領域 生体プロセス工学研究室のヤリクン・ヤシャイラ准教授と細川 陽一郎教授、
株式会社ユーグレナ(代表取締役社長:出雲 充)の鈴木 健吾執行役員CTO、 理化学研究所 生命機能科学研究センターの田中 陽チームリーダー、
オーストラリア・マッコーリー大学のLi Ming(リ ミン)講師、 中国科学院深海科学技術研究所のYang Yang(ヤン ヤン)教授は共同で、
有用な生物資源とされる藻類の一種であるユーグレナ(和名:ミドリムシ、 以下ユーグレナ)について、
細胞のサイズと含まれる成分の変化をインピーダンス信号を指標にして高速で計測できるマイクロ流体デバイスを開発しました(図1)。
これまで開発したマイクロ流体デバイス※1では、 藻類の細胞外部形状の判断のみ可能でしたが、 今回の開発により、
さらにサイズ変化と有用物質の含有量変化の情報を得ることができ、 生産性が高い特定藻類の選別や培養方法の定量化への活用が期待されます。
※1 2021年8月10日のリリース
https://www.euglena.jp/news/20210810-2/
近年、 地球温暖化を産業で解決するため、 植物や微生物が行う光合成を利用し、 工場などから排出される二酸化炭素から有用物質をつくる研究が進んでいます。
特にユーグレナは、 利用価値が高い多糖類(パラミロンなど)を産み出すため、 食品、 医薬品、 バイオプラスチックの原料としての研究が進んでいます。
今後さらに産業での利用を促進するためには、 光合成を行う細胞小器官を多く含み、 有用物質であるパラミロンの生産性が高い特定のユーグレナ株の選別が鍵となります。
従来の特定のユーグレナ株の選別方法は、 顕微鏡下で画像を見るなどの光学的な方法で個別のユーグレナの形状などを判断していましたが、
コストや処理能力の改善が望まれていました。 そこで、 本研究グループは、 インピーダンス(電流の流れにくさ)信号を指標に計測するシステムを開発し、
マイクロ流体デバイスの中を連続して流れるユーグレナの形状・サイズ、
有用物質であるパラミロン合成に直結する細胞小器官(葉緑体)の分布とパラミロンの含有量を瞬時に判別できることを示しました。
今回は、 複数の異なる周波数の交流電圧を印加した電極を並列に配置して、 それぞれの特性の計測に必要な複数のインピーダンスを計測することで、
ユーグレナの形状・サイズなどの外見的な特性と、 パラミロンの含有量の変化とを統合的に計測・分析ができるシステムの開発に成功しました。 このシステムは、
超小型でユーグレナ以外の藻類や微生物にも応用可能であり、 長期連続計測・分析が求められるフィールドでの生体試料の常時モニタリングを可能にしました。
このように、 微生物細胞の内外の変化の統合的な計測・分析システムを発展させることで、 急速に高まっている藻類産業(スマートセル産業)への展開をはじめ、 創薬、
疾病治療、 生命科学研究の質や効率の向上が期待されます。
今回の研究成果は、
2022年6月24日(金)に英科学誌「マイクロシステムズ・アンド・ナノエンジニアリング」(ネイチャーパブリッシング発行)にオンライン掲載されました。
【本研究成果の掲載URL】
Microsystems & Nanoengineering
https://www.nature.com/articles/s41378-022-00405-y
【解説】
緊迫している地球温暖化の対策の一つとして、 工場廃棄ガスや大気中の二酸化炭素から藻類を用いて有用物質を生産する取り組みが行われています。
藻類は二酸化炭素と水から光合成を行い、 糖をはじめとする有用物質をつくり、 細胞内に蓄積する特性があります。 それに加え、
増殖が速く比較的簡便に有用物質の生産を制御できるため、 工業生産に向いていると言われており、 医薬品や食品、 化粧品に利用する研究も盛んです。
藻類の中でもユーグレナは、 生物界でも稀な多糖類であるパラミロンを蓄積します。 パラミロンを大量に生産・蓄積する性質のユーグレナ株を選定・培養することは重要で、
そのためには迅速で簡便に形状とパラミロンの含有量の評価が必要となります。
【今までの問題点】
これまで、 大量のユーグレナの形状と有用物質であるパラミロンを識別するためには、 顕微鏡下で写真を撮り、 個々の細胞を画像として取得していました。 さらに、
処理能力を上げる目的でマイクロ流体デバイスの流路中にユーグレナを高速で流して高速度カメラで撮像する方法や、 蛍光イメージング、
ラマン散乱等の光散乱を用いる光学的に観察する方法が開発されています。 これらの方法は、 複雑な光学システムが必要となるため、
装置そのものが大型でコストもかかり、 結果としてユーグレナを計測することへの利用が制限されていました。
【本研究の目的と得られた解決方法】
本研究グループは、 マイクロ流体デバイスの流路に配置した微細な電極間に複数の異なる周波数の交流電圧を印加し、
その電場に進入したユーグレナなど対象によるインピーダンス信号の変化を計測します(図2)。 細胞の特定成分の含有量を信号の振幅として、
サイズ(体積)を信号幅として、 形状(または細胞小器官の分布)を偏心率(信号の立ち上がりと立ち下がりのズレ)として計測します。 さらに、
複数の周波数の電場を利用することによって、 異なる細胞の部位(細胞膜、 細胞質、 細胞小器官)をそれぞれ判別できます。 例えば、 500
KHzの信号は細胞膜を通過できないため、 信号の特徴は細胞の形状・サイズと相関関係があります。 10 MHzの信号は、 細胞膜を通過できますが、
2重膜構造の葉緑体、 結晶構造のパラミロンなど細胞小器官で減衰するため、 葉緑体・パラミロンの含有量・分布と相関関係があります。 結果として、
インピーダンスを測定するだけで細胞外部形状・サイズ変化とパラミロンの含有量変化を得ることができます。
本手法の有用性を証明するために、 異なる培養条件において育生したユーグレナの細胞のサイズとパラミロンの含有量を既存手法と本手法とで計測して比較したところ、
双方の結果が一致し、 本手法の有用性・信憑性・実用性が確認できました。
【本研究の意義】
微生物の内外変化の多項目の統合的な計測・分析は、 既存計測システムの高コストや処理能力の不足、 小型化・自動化が困難などの原因によって制限されていました。
本研究グループが開発したインピーダンス計測システムでは、 マイクロ流体デバイスでの簡便なインピーダンス計測技術を用いて連続に流れてくるユーグレナの形状・サイズ、
パラミロンの分布と含有量を瞬時に統合的に計測・分析できます。 これによって、 急速に高まっている藻類産業(スマートセル産業)への展開をはじめ、 創薬、
疾病治療または生命科学研究の質や効率の向上が期待されます。
【補足説明】
〇ユーグレナ:藻の一種でありながら鞭毛を持ち、 光に向かって水中を泳ぐことができる単細胞生物で、 体内に多数の葉緑体を持ち、
光合成で水と二酸化炭素からグルコースを産生します。 このグルコースから多糖類であるパラミロンをつくり、 顆粒として体内に貯め込みます。
低酸素環境にするとパラミロンからオイルをつくります。 自然界では主に淡水に生息していますが、 排水や、 塩を含む水でも生育できます。
〇マイクロ流体デバイス:半導体微細加工技術や精密機械加工技術を用いて作製された、 幅・深さが数μm~数100 μm程度の流路構造(髪の毛の直径は200
μm)を集積したチップ状のデバイスです。
〇インピーダンス:交流電圧を物質に印加し、 流れる微弱な電流を測定し、 その際の電圧を電流で割って得られる量をインピーダンスといいます。
【添付資料】
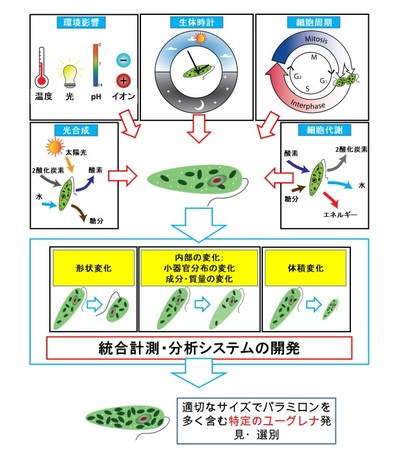
図1.本研究の目的と位置付け。 ユーグレナの形状やサイズ(体積)、 細胞内器官や有用物質であるパラミロンの含有量の変化は、 ユーグレナの持つ生体時計、 代謝、
細胞周期など細胞自体の能力や、 培養環境と密接に関係します。 このため、 パラミロンの生産性が高い特定のユーグレナの選別には形状やサイズ、
細胞小器官分布と成分変化を統合的に計測・分析することが必要です。 このような特性を高速・大量・正確に計測できることが、 効率的な株選別の重要課題になります。

図2.高速で流れる細胞と細胞小器官などのインピーダンス測定。 マイクロスケールの流路にある微細な電極間に4種の周波数(500 KHz, 4 MHz, 7
MHz, 10 MHz)の交流電圧を印加し、 電場に進入したユーグレナ細胞により変化したインピーダンス信号を計測します。 ユーグレナ細胞の場合、
低い周波数の信号は形状・サイズ(体積)計測に使用します。 高い周波数の信号は、 細胞質、 細胞小器官の分布・含有量などの計測に用います。

図3.ユーグレナの形状・パラミロンの含有量を計測した結果と既存手法で得られた結果との比較。 (a) PBS培地(生理的リン酸緩衝液、
栄養は含まない)とCM培地(Cramer and Myers培養液、 栄養あり)を用いて、 4日間連続光照条件でユーグレナ細胞を培養しました。
ユーグレナ細胞の外見と内部変化は写真から分かります。 (b) まず、 通常手法の同じ量の微生物を乾燥して重量を計測し、 ユーグレナ細胞の質量を調査しました。
PBS培地に含まれる栄養が少ないため、 PBS培地でのユーグレナ細胞の繁殖が抑えられ、 PBS培地でのユーグレナ細胞の数はCM培地でのユーグレナ細胞の数と比べ、
少ないことがわかります。 しかし、 CM培地とPBS培地でのユーグレナ細胞の質量は大きく変わらないので、
CM培地のユーグレナ細胞の数はPBS培地のユーグレナ細胞の数より多いが、
CM培地のユーグレナ細胞の大きさはPBS培地のユーグレナ細胞の大きさより小さいことがわかります。 (c)当システムで計測した結果です。
図中では分かりやすくるすため、 PBS培地で培養したユーグレナ細胞サイズの変化を赤の矢印、 CM培地中での変化を青の矢印で示しました。 低い周波数場合、
1.一日目、 PBS培地のユーグレナ細胞のサイズのほうが大きいですが、 2.2日目から、 徐々にCM培地のユーグレナ細胞のサイズとの差が小さくなります。
高い周波数でも同じことが確認できます。 CM培地では分裂状態にあるユーグレナ細胞が多いため、
平均サイズはPBS培地のユーグレナ細胞のサイズより大きいとわかります。 3.3日目、 分裂したあとのユーグレナ細胞のサイズが小さく、
パラミロンの含有量も少なくなったため、 PBS培地のユーグレナ細胞より小さくて、 パラミロンの含有量の減少も確認できます。 しかし、
CM培地のユーグレナ細胞の持続的な繁殖によって、 3日目は小さくて、 パラミロンの含有量も少ない細胞が多いですが、 十分な栄養があるので、
4.4日目から時間増加に伴い、 サイズとパラミロンの含有量の増加傾向が確認できます。 一方、 PBSにいる細胞は光合成によって、
最初はサイズとパラミロンの含有量を維持できているように見えますが、 3.3日目から、 減少の傾向が確認できます。 栄養不足によって、
蓄積されているパラミロンを消耗し始め、 4.サイズも小さくなっていくことがわかります。





ディスカッション
コメント一覧
まだ、コメントがありません