新型コロナウイルス変異株の抗体量を8分で自動定量
抗体がどれくらいウイルスの体内細胞への感染を防御できるかの目安になります。 本開発成果により、 SARS-CoV-2ワクチン接種の効果を、
変異株に関してもその場で精密検査することが可能になります。 また、 このシステムを用いると、 今後新たに生じる変異株に関する検査も容易に行うことができます。
アール・ナノバイオ株式会社は、 理化学研究所(理研)と千葉大学大学院医学研究院との共同研究により、 ヒトの指先から1滴の血液を採り、
新型コロナウイルス(SARS-CoV-2)の各種変異株に対する抗体量を、 8分で自動測定するシステムを開発しました。
本研究成果により、 SARS-CoV-2ワクチン接種の効果を、 変異株に関してもその場で精密検査することが可能になります。 また、 このシステムを用いると、
今後新たに生じる変異株に関する検査も容易に行うことができます。
今回、 共同研究グループは、 SARS-CoV-2を構成するヌクレオカプシド・タンパク質[1]とスパイク・タンパク質[2]、
さらに変異株6種のスパイク・タンパク質(デルタ株、 オミクロン株由来を含む)を一つのマイクロアレイチップ[3]上に固定化し、
それら複数のタンパク質に対する抗体量を完全自動で定量測定できることを示しました。 スパイク・タンパク質に結合する抗体の量は、
抗体がどれくらいウイルスの体内細胞への感染を防御できるかの目安になります。
本研究は、 科学雑誌『Analytical Sciences』オンライン版(8月2日付:日本時間8月2日)に掲載されました。
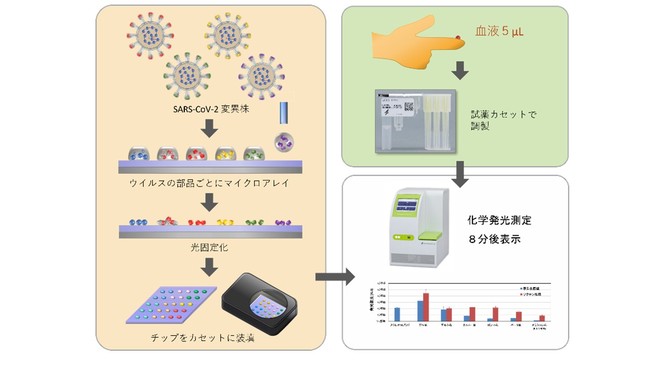
SARS-CoV-2タンパク質を固定化したマイクロアレイチップによる迅速な抗体診断システム
背景
現在、 新型コロナウイルス(SARS-CoV-2)に対するワクチン接種が行われています。
ウイルス感染もしくはワクチン接種により抗体ができたかどうかを調べる抗体検査は、 医療現場において検体をろ紙の上に滴下するだけで、
10-15分程度で検査できる免疫クロマトグラフィ―法と、 分析センターに運んで、 酵素を結合した抗体を用いて、
あらかじめ吸着させておいた物質に相互作用した分析対象物を定量する酵素結合抗体吸着法(ELISA法、 Enzyme-Linked Immuno Sorbent
Assay)の略に分類されます(図1)。
理研では2003年、 生体由来の物質など有機化合物であれば何でも基板に固定化できる「何でも固定化法」を開発し、
免疫履歴を測定できるシステムへ応用しました(注1)。 2020年2月からは、 特異的IgE検査キット「ドロップスクリーン」(注2)が、
日本ケミファ株式会社から販売されています。 そして、 2021年にはこのシステムを発展させ、
SARS-CoV-2を構成するいくつかのタンパク質をマイクロアレイの基板に固定し、 それらに対するヒト血清内の抗体の有無を調べられることを報告しました注3)。
今回、 そのシステムをさらに改良し、 変異株に対する抗体量も測定でき、 指先から採取したわずか5マイクロリットル(mL、 1mLは100万分の1リットル)、
つまり1滴の血液を用いて8分で測定できるようにしました(図1)。
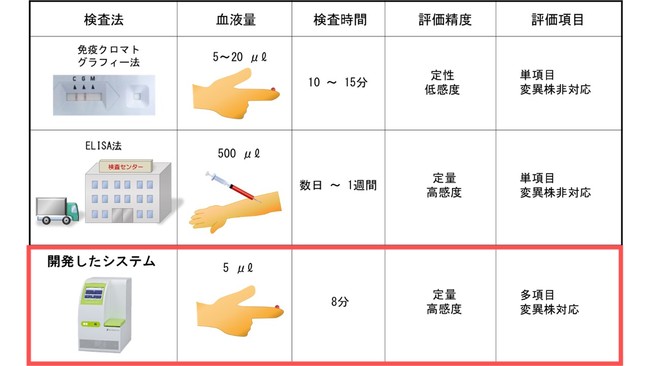
図1 現在の新型コロナウイルス抗体の検査法と本開発技術
現在のウイルス抗体検査には、 医療現場における免疫クロマトグラフィー法による簡易検査、 もしくは分析センターにおける精密検査がある。
今回の開発技術では1滴の血液を用いて変異株に対する抗体量が8分で測定できる。
注1)2013年12月19日プレスリリース「免疫履歴がその場で分かるマイクロアレイ診断システムを開発」
https://www.riken.jp/press/2013/20131219_1/index.html
注2)2019年10月23日プレスリリース「血液1滴からその場で41種類のアレルギー検査ができるシステムの開発」
https://www.riken.jp/pr/news/2019/20191023_2/index.html
注3)2021年9月3日プレスリリース「新型コロナウイルス抗体を「その場」で測定」
https://www.riken.jp/press/2021/20210903_2/index.html
研究手法と成果
この手法では、 まず光反応性で非特異吸着を抑制する合成高分子をチップ(基板)上に被覆し、 そこへウイルスのタンパク質をスポット状に配置します。 その後、
紫外線照射による光架橋[4]で、 タンパク質がチップに固定化されたマイクロアレイチップを作製します。 タンパク質には、
SARS-CoV-2の内部にあるヌクレオカプシド・タンパク質と、
表面にある変異株ごとに異なるスパイク・タンパク質の一部(感染する細胞に接着する部位)を選びました。
このマイクロアレイチップを利用したウイルス・マイクロアレイシステムでは、 検体血清中に各ウイルス・タンパク質に結合する抗体があると発光し、
その発光像をCCDカメラで撮影することで、 抗体の多寡を判定します(図2)。 検査は、 指先から血液1滴(5mL)を採取してカートリッジに入れ、
チップとともに装置にセットしてスイッチを押すだけです。 完全自動により、 チップへの血液の滴下、 試薬との反応、 洗浄、 検出という一連の工程は8分間で完了し、
測定結果が装置上に表示されます。 このシステムによって得られたデータは酵素結合抗体吸着法(ELISA法)による検査結果と高い相関性で一致しました。

図2 SARS-CoV-2タンパク質を固定化したマイクロアレイチップによる抗体検査原理
タンパク質をスポット状に固定したマイクロチップの上に検体血液を滴下すると、 ウイルス・タンパク質に対する抗体があると結合して発光する。
その化学発光シグナルをCCDカメラで撮影することで、 それぞれの抗体の量を測定できる。
図3に、 SARS-CoV-2感染後回復者(ワクチン接種歴なし)と非感染のワクチン接種者、
それぞれの血清の免疫グロブリンG(IgG)[5]という抗体をマイクロアレイチップによって検出した例を示します。
感染後回復者はウイルス内部のタンパク質であるヌクレオカプシド・タンパク質に対する抗体ができているのに対し、
非感染者(スパイク・タンパク質ワクチン接種者)はできていません(棒グラフ左端)。
一方、 スパイク・タンパク質に対する抗体は、 感染後回復者、 ワクチン接種者ともに形成されています。 感染時期、 ワクチン接種時期によりますが、 図3の場合は、
ワクチン接種により、 より多くの抗体ができています。 その抗体量は、 SARS-CoV-2の変異が進行するほど(野生株よりデルタ株、
さらにオミクロン株)少なくなるものの、 ワクチン接種により変異株に対する感染防御効果を持つ抗体がある程度作られることが示されました。
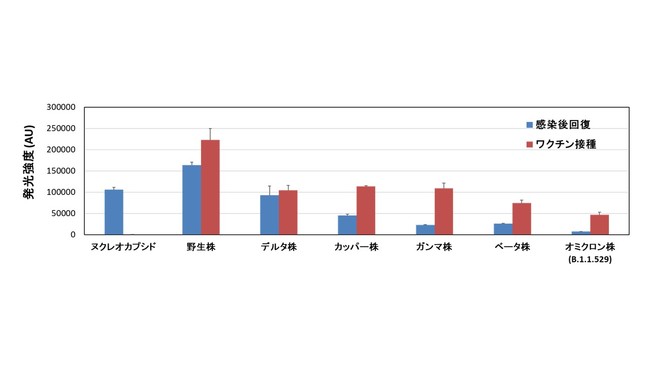
図3 感染後回復者とワクチン接種者の抗体量の比較
ウイルス内部のヌクレオカプシド・タンパク質と、 野生株および5種の変異株のスパイク・タンパク質に対する抗体量を示す。
また、 3回目ワクチン接種前後で変異株のスパイク・タンパク質に対する抗体量を調べた結果、 2回目ワクチン接種から6カ月以上たつとかなり減少していましたが、
3回目ワクチン接種をすれば1カ月後にはかなりの抗体ができることも示されました(図4)。 このようなデータを集積すれば、
ワクチン接種の適正な時期やワクチンの有効性を判断するために役立つと考えられます。
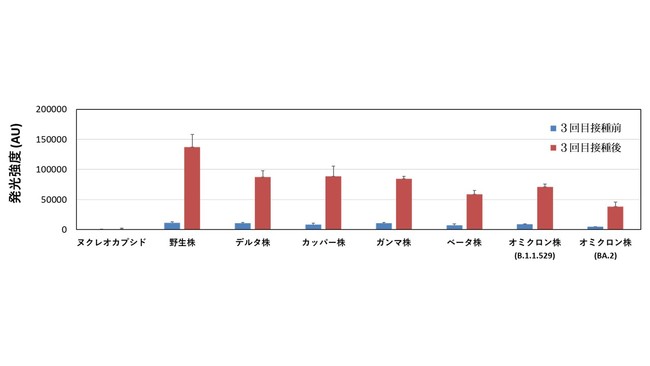
図4 3回目ワクチン接種前後の抗体量の比較
ウイルス内部のヌクレオカプシド・タンパク質と野生株および6種の変異株のスパイク・タンパク質に対する抗体量を示す。
今後の期待
これまでに研究チームは、 「何でも固定化法」を用いて、 多種類のアレルゲン、 自己免疫抗原、 感染症ウイルスをマイクロアレイの基板に固定したチップでアレルギー、
自己免疫疾患[6]、 感染症履歴を、 多項目検査できることを示し、 今回、 SARS-CoV-2抗体検査用の実用的システムを作ることに成功しました。
本システムにより、 医療現場での抗体価精密検査が可能になります。 感染流行中に個人個人がさらにワクチン接種をする必要があるかを判断し、
疫学調査を基にした今後の感染状況の予測、 ワクチン接種による免疫獲得の検証、 変異株対応ワクチン開発の必要性判断など、
パンデミックへの対応にも利用できると期待できます。
論文情報
<タイトル>
Rapid and quantitative detection of multiple antibodies against SARS-CoV-2
mutant proteins by photo-immobilized microarray
<著者名>
Jun Akimoto, Hiroharu Kashiwagi, Nobuhiro Morishima, Sei Obuse, Takashi
Isoshima, Takahiro Kageyama, Hiroshi Nakajima, and Yoshihiro Ito
<雑誌>
Analytical Sciences
<DOI>
10.1007/s44211-022-00161-z
補足説明
[1] ヌクレオカプシド・タンパク質
ウイルスの内部にあるタンパク質で、 ウイルス遺伝子を包む働きを持つ。
[2] スパイク・タンパク質
ウイルスの表面にあるタンパク質で、 感染する際に細胞表面にある受容体に結合する。
[3] マイクロアレイチップ
複数の標的分子を1枚のチップ上に微小スポットとして固定化したもので、 固定化するものによって、 DNAチップやプロテインチップとも呼ばれる。
[4] 光架橋
光反応性の官能基が光照射によって活性化され、 近くの有機物と反応して高分子同士を橋架けすること。
[5] 免疫グロブリンG(IgG)
ヒトの抗体は大きく分けてIgM、 IgD、 IgG、 IgA、 IgEの5種類がある。 IgGは血液中で最も多い抗体であり、 70~75%を占める。
特定の相手(抗原)に結合して複合体を形成し、 それが白血球やマクロファージに認識されて排除される仕組みにおいて重要な役割を担うほか、
ウイルス表面に結合して感染を防ぐ作用(中和作用)も持つ。 このようにしてIgGは危険因子を無毒化する。
[6] 自己免疫疾患
体内で自己の抗原に対して免疫応答を起こして、 自己抗体を産生し、 自己抗原となった臓器・組織で強い炎症反応が発症する疾患。 バセドウ病、
関節リウマチなどが知られる。
共同研究グループ
理化学研究所
創発物性科学研究センター 創発生体工学材料研究チーム
客員研究員 秋元 淳 (アキモト・ジュン)
(アール・ナノバイオ株式会社 上級研究員)
人材派遣 柏木 裕晴 (カシワギ・ヒロハル)
研究パートタイマーI 小布施 聖 (オブセ・セイ)
チームリーダー 伊藤 嘉浩 (イトウ・ヨシヒロ)
(開拓研究本部 伊藤ナノ医工学研究室 主任研究員)
開拓研究本部 伊藤ナノ医工学研究室
客員研究員 森島 信裕 (モリシマ・ノブヒロ)
(アール・ナノバイオ株式会社 上級研究員)
専任研究員 礒島 隆史 (イソシマ・タカシ)
千葉大学 大学院医学研究院 アレルギー・臨床免疫学
教授 中島 裕史 (ナカジマ・ヒロシ)
特任助教 影山 貴弘 (カゲヤマ・タカヒロ)
千葉大学 大学院医学研究院 アレルギー・臨床免疫学
教授 中島 裕史(ナカジマ・ヒロシ)







ディスカッション
コメント一覧
まだ、コメントがありません