小胞体での脂質のグルコース化反応は低酸素ストレスによる細胞死を抑制する
小胞体での脂質のグルコース化反応は低酸素ストレスによる細胞死を抑制する ―脂質により誘導される小胞体ストレスへの新たな細胞応答機構―
順天堂大学大学院医学研究科環境医学研究所 平林義雄客員教授(理化学研究所(理研)・客員主管研究員兼任)、 岩渕和久教授、
理研脳神経科学研究センター(CBS)神経細胞動態研究チーム Hui-Hing Hung研究員(研究当時。 筆頭著者)・上口裕之チームリーダーらの研究グループは、
群馬大学、 かずさ研究所、 サンフォード・バーナム・プレビーズ・メディカル・ディスカバリー・インスティテュート、
スイス連邦工科大学ローザンヌ校との国際共同研究により、 糖タンパク質グルコース転移酵素であるUGGT2が脂質代謝の制御に必須であり、
UGGT2による脂質の糖修飾反応が低酸素状態における小胞体(ER)品質管理システムの必須構成要素であることを明らかにしました。
ERでの脂質のグルコシル化(糖化反応)を通じて飽和脂肪酸を含む脂質により誘導される持続的な ER ストレスによる細胞死を抑制すると考えられます。
本論文は米国科学アカデミー紀要(PNAS, Proceedings of the National Academy of
Sciences)に2022年12月13日付(日本時間)で公開されました。 本研究成果のポイント * 小胞体での脂質誘導型ストレスの細胞応答機構を解明
*
低酸素で産生される細胞傷害性脂質による細胞死を防御する糖修飾反応を発見
*
脂質性ERストレスによる種々の代謝疾患の新たな診断・治療の分子基盤を提供
背景
細胞内のタンパク質や脂質の生合成の大部分は小胞体(ER)と呼ばれている細胞内小器官で行われています。ERの恒常性は、タンパク質と脂質代謝を正しく行う高度な管理機構よって維持されていますが、その管理機構が損なわれるとERストレスが引き起こされます。ERストレスは糖尿病、アルツハイマー病、パーキンソン病、癌など、多くの疾患の発症に重要な役割を担っており、その管理機構を理解することはそれらの疾患の治療や予防において大変重要であるといえます。糖転移酵素1
(UGGT1) は、タンパク質品質管理 (PQC)
システムの重要なコンポーネントであり、不良タンパク質を糖化することで、不良タンパク質の蓄積を抑制しています。高濃度の飽和脂肪酸(sFA)もまた小胞体ストレスを引き起こし、UPR(unfolded
protein response)
と呼ばれている細胞応答を引き起こすことが分かっていますが、タンパク質に相当する脂質の品質管理(LQC)システムはこれまで見つかっていませんでした。今回、研究グループはタンパク質に相当する脂質の品質管理システムを見つけることを目的にER型のグルコース化脂質の生合成に着目して研究を行いました。
内容
細胞膜表面には細胞分化関連抗原として長鎖の飽和脂肪酸を主とするホスファチジン酸にグルコースが結合した糖脂質、「ホスファチジルグルコシド(PtdGlc)」が存在しています。グルコースの存在が生理活性の発現に決定的に重要であり、まず、糖脂質の生合成酵素を検索した結果、ERに局在している生理機能が不明な糖転移酵素UGGT2を見いだしました。精製したUGGT2タンパク質と基質として飽和脂肪酸を含むホスファチジン酸(sPA)をグルコース供与体としてUDP-グルコース存在下で酵素反応を行い生成物を質量分析すると、PtdGlcの産生が認められたものの(図1)、UGGT1の合成活性は認められませんでした。
図1 小胞体型糖脂質の生合成反応
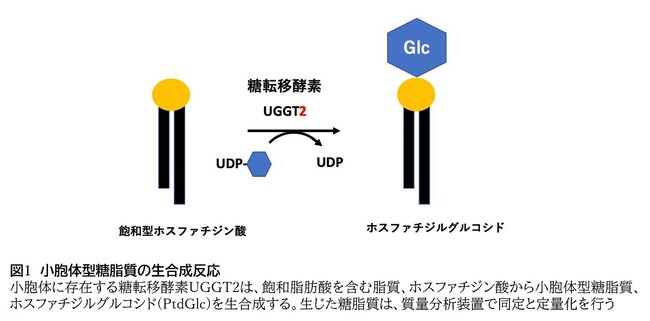
図1 小胞体型糖脂質の生合成反応
次にPtdGlc産生の生理的役割を解明するため、UGGT2遺伝子の欠損したマウス胚性繊維芽細胞(MEF)株を用いた解析を行いました。PtdGlcを構成している脂肪酸が飽和型であることに着目し、飽和脂肪酸を不飽和脂肪酸に変える不飽和化酵素(SCD1)の特異的阻害剤を添加したところ、正常の細胞ではPtdGlcが顕著に上昇するのに対して、UGGT2の欠損細胞は糖脂質の産生が激減し、ERストレスによる細胞死が引き起こされました。SCD1は酸素要求性の酵素であることから、低酸素の環境下では飽和型脂肪酸の濃度が上昇します。そこで、低酸素下でのUGGT2遺伝子のノックアウトMEF細胞を調べたところ、同じように細胞死が引き起こされていることがわかりました。
UGGT2の働きにより産生される糖脂質が、なぜ低酸素環境下で細胞死を抑制するのかを調べる目的で、PtdGlcの細胞内局在を糖脂質に特異的に反応する抗体を使って調べたところ、リソゾーム膜に濃縮されていることがわかりました。さらに、UGGT2による糖脂質合成の欠損がなぜ細胞死を起こしてしまうのかを検討したところ、SCD1阻害剤および低酸素環境下で、UGGT2欠損細胞特異的にERのストレスセンサーであるPERKとその下流シグナルが活性化されることが示されました。他のストレスセンサーであるATF6,IRE1には変化がないことから、PERKは飽和型の脂質ストレスに特異的なERセンサーであり、UGGT2によりsPAを糖化することにより脂質で誘導されるERストレスから回避していると考えられました(図2)。図2 低酸素ストレスにより誘導される細胞傷害性脂質によるERストレスとUGGT2による感知・応答機構
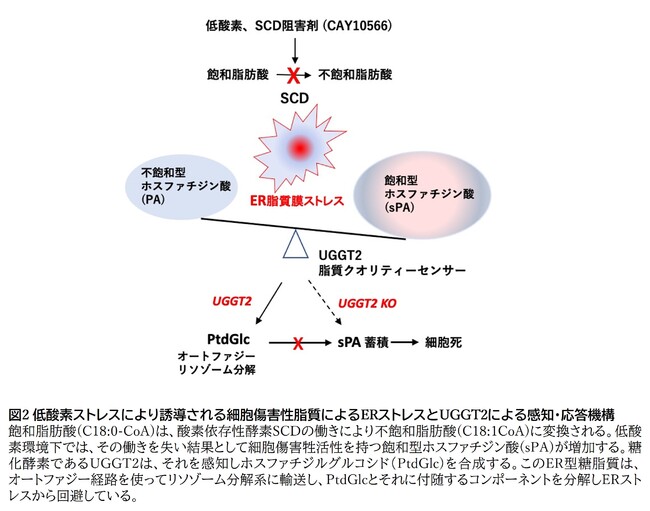
図2 低酸素ストレスにより誘導される細胞傷害性脂質によるERストレスとUGGT2による感知・応答機構
これらの結果から、ERには細胞傷害性の脂質を認識するセンサー機能が備わっていること、さらにUGGT2による脂質のグルコース化反応は、ER-リソゾーム分解経路を経由して傷害性脂質のクリアランス機構に関与していることが明らかになりました。
今後の展開
今回の研究では、ERでの糖脂質合成に関わる転移酵素UGGT2が脂質のクオリティーの感知機能に関与していることがわかりました。UGGT2がどうのようにして脂質のクオリティーを識別しているかの詳細は不明であり、今後の生化学的解析だけでなく、構造生物学的な解明が待たれます。一方、持続的な脂質ストレスにより誘導される疾患として2型糖尿病、統合失調症、がんの悪性度などが考えられています。今後、糖脂質PtdGlc、およびその代謝産物を認識している脂質応答性受容体GPR55の疾患への関与を明らかにすることにより、新たな診断・予防法の開発が進むことが期待されます。
用語解説
小胞体(ER)とERストレス:
小胞体(ER)は、最も大きな面積を占める細胞内小器官であり、ほとんど全てのタンパク質と脂質の生合成を担っている。細胞の内外からの様々な負荷(低酸素、代謝、カルシウムイオンなど)により不良のタンパク質が蓄積するとERストレスが引き起こされる。ERの脂質2重層の膜ストレス、例えば飽和型長鎖脂肪酸を含むホスファチジン酸の過剰な蓄積はERストレスによる細胞死を引き起こす。
グルコース転移酵素UGGT1:
UGGTは、ERに存在しているグルコース転移酵素であり、ERで合成される糖タンパク質の立体的構造を認識するホールディングセンサーとして働いている。脊椎動物、線虫にはUGGT1の他にパラログ遺伝子UGGT2が存在しているが、その機能は長い間不明であった。
SCD1:
ステアリン酸CoAを基質として脂肪酸直鎖の9と10番目の間に2重結合を導入する酵素で、ERに存在する。分子状の酸素を要求する。
ホスファチジルグルコシド(PtdGlc):
長鎖飽和脂肪酸を主とするホスファチジン酸にグルコースがβ結合した糖脂質である。構成している脂肪酸が主に飽和型であることから、生体膜では脂質ラフト(筏)に局在している。極めて微量な膜脂質であるが、炎症、低酸素など小胞体ストレスにより産生されてくる。その代謝産物であるリゾ体脂質は、脂質を感知する受容体であるGPR55の生理的リガンドとして機能している。
原著論文
本論文は米国が発行する学術雑誌、米国科学アカデミー紀要(PNAS, Proceedings of the National Academy of
Sciences)に2022年12月13日付で公開されました。
タイトル: Selective involvement of UGGT variant: UGGT2 in protecting mouse embryonic
fibroblasts from saturated lipid-induced ER stress
タイトル日本語訳:UGGTバリアントの選択的役割 – UGGT2は飽和脂肪酸により誘導されるERストレスからマウス胚性線維芽細胞を防御している
著者:Hui-Hsing Hung 1, Yasuko Nagatsuka 1, Tatiana Soldà 2, Vamsi K Kodali 3,
Kazuhisa Iwabuchi 4, Hiroyuki Kamiguchi 1, Koki Kano 5, Ichiro Matsuo 5,
Kazutaka Ikeda 6, Randal J Kaufman 3, Maurizio Molinari 2,7, Peter Greimel 1,
Yoshio Hirabayashi 4,8
著者: (日本語表記): フュイ-シング ハン1、長塚 靖子 1、 タティアナ ソルダ2、 バミス コダリ 3、 岩渕和久4、 上口裕之 1、 狩野航輝 5、
松尾一郎 5、 池田和貴 6、 ランダル カウフマン 7、 マウリジオ モリナリ 8、 ペーター グレイメル1、 平林義雄 4、8
著者所属: 1. 理化学研究所・CBS、 2. スイスUSI大学、 3. サンフォード・バーナム・プレビーズ・メディカル・ディスカバリー・インスティテュート、
3. スイス連邦工科大学ローザンヌ校、 4. 順天堂大学大学院・環境医学研究所、 5. 群馬大学大学院・理工学府分子科学部門、
6.かずさ研究所・生体分子解析グループ、 7. スイス連邦工科大学ローザンヌ校、 8. 理化学研究所・開拓研究本部
DOI: 10.1073/pnas.2214957119
研究支援
本研究は、主に、日本学術振興会 科学研究費助成事業
特別推進研究「小胞体糖修飾の統合的ケミカルバイオロジー」(統括代表:伊藤幸成)、AMED―CREST「グルコース関連脂質の作動機序を基軸とした疾患メカニズムの解明」(統括代表:上口裕之)により行われました。
なお、本研究にご協力いただいた皆様には深謝いたします。





ディスカッション
コメント一覧
まだ、コメントがありません