薬物による副作用が皮膚で起こりやすい原因を発見~ヒト白血球抗原を介した細胞内からのストレスが引き金~
青木重樹講師、伊藤晃成教授、大学院博士後期課程4年(研究当時)の風岡顯良氏らの研究グループは、独自に作出したヒト白血球抗原(HLA)(注1)の導入マウスを用いて、特定の人において薬物による副作用が皮膚で生じやすいしくみを解明しました。
研究グループは、皮膚を構成する細胞内で特定のHLAと薬物が結合して生じる“不良品タンパク質”がストレスを発生させ、そのストレスが過剰な免疫の活性化の引き金になることを見出しました。免疫の活性化の延長線上で重篤な副作用に発展することから、この成果によって副作用の予防や治療法の開発に役立ち、個別化医療への貢献も期待されます。
本研究成果は、2024年4月2日(現地時間)に、米国科学誌PNAS Nexusで公開されました。 * 研究の背景
薬物による副作用の中で特に報告の多いものが、発赤、水疱、かゆみなど皮膚で広範に生じる薬疹です。重篤な
薬疹には、スティーヴンス・ジョンソン症候群や中毒性表皮壊死症があり、死亡率も決して低くはありません。市販の風邪薬によっても起こることがあるため、注意しなければならない副作用の一つです。しかし、なぜ生じるのかといったメカニズムや、皮膚組織で副作用が起こりやすい理由は明らかになっていませんでした。
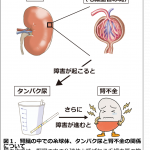
これまでのゲノム解析から、いくつかの薬物による薬疹の発症には、HLAが関係することが示唆されていました。HLAはT細胞に抗原を提示する分子であり、免疫の活性化を制御する重要な役割を担っています。HLAが関係した薬物による副作用は、HLAと薬物の相互作用が起因となって、免疫の活性化に至るという仮説が考えられています。そこで、研究グループは、HLAの導入マウスを作製して、HLA依存的に生じる副作用の再現を行ってきました(図1)。しかしこれまでの研究から、マウスにおいても人と同様に皮膚組織で強い免疫の活性化が起きていることは分かっていましたが、詳細なメカニズムは不明なままでした。
図1:HLA依存的に生じる薬疹とマウスを用いた再現実験

図1:HLA依存的に生じる薬疹とマウスを用いた再現実験
* 研究の成果
皮膚組織の中で、全身を覆っている表皮の大部分は、ケラチノサイト(注2)と呼ばれる細胞で構成されています。まず、研究グループは、HLAを導入したマウスからケラチノサイトを採取し、薬物を曝露しました。ここでは、HLAのサブタイプの一つであるHLA-B*57:01と、それによる副作用が報告されているHIV治療薬であるアバカビルの組み合わせに着目して検討しています。その結果、HLA依存的にサイトカイン(注3)やケモカイン(注4)の発現が上昇することを発見しました(図2)。
これらの現象は、ケラチノサイト以外の細胞では起こらず、ケラチノサイトに特異性が高く生じていると考えられます。この実験では、T細胞などの免疫を活性化する細胞は一切登場しません。つまり、皮膚に存在するケラチノサイトがHLA依存的に薬物と反応して免疫シグナルを発していることを世界で初めて見出しました。
図2:ケラチノサイトにおけるHLA依存的なサイトカイン・ケモカインの発現上昇

図2:ケラチノサイトにおけるHLA依存的なサイトカイン・ケモカインの発現上昇
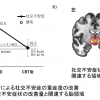
次に、ケラチノサイトの細胞内で起きている現象を調べるために、発現遺伝子の網羅的解析を行ったところ、小胞体ストレス(注5)と呼ばれる細胞内小器官が関連したストレスが発生していることが判明しました。これは、HLA-B*57:01を発現するケラチノサイトにアバカビルを曝露して数十分という短い時間で起こる現象です。さらに、このストレスをケミカルシャペロン(注6)の一つである4-フェニル酪酸を用いて緩和させたところ、サイトカインやケモカインの発現上昇が起こらなくなりました。
この結果から、小胞体ストレスによりサイトカインやケモカインの発現が誘導されていたと考えられます。また、このケラチノサイトで生じるストレスは、T細胞の運動性も亢進させていたことから、ケラチノサイトを中心に免疫の活性化が誘導されていると考えられます。さらに、HLAの導入マウスに薬物を経口投与して数時間後にも皮膚の表皮部分で強い小胞体ストレスのシグナルが確認されましたが、それは他の臓器では起きていませんでした。小胞体ストレスを抑制することによって、HLAの導入マウスで生じていた薬疹症状が緩和されたことから、小胞体ストレスが薬疹の発症を決める重要な原因であると考えられます(図3)。
図3:薬疹の発症に与えるHLA依存的な小胞体ストレスとそれを生むHLAと薬物の結合

図3:薬疹の発症に与えるHLA依存的な小胞体ストレスとそれを生むHLAと薬物の結合
小胞体ストレスは、タンパク質合成過程の不具合で生じた“不良品タンパク質”が蓄積することによって引き起こされます。そこで、研究グループは、アバカビルと結合したHLA-B*57:01は小胞体内で不良品タンパク質と認識されているのではないかと考えました。しかし、HLAは細胞表面上に発現しているタンパク質としてよく知られており、小胞体内(細胞内)のHLAを議論するためには、細胞表面上のHLAと区別する必要があります。
よって、ブレフェルジンAと呼ばれるタンパク質の輸送阻害剤を用いて細胞表面上のHLA発現を抑制させ、そこにアバカビルの曝露を行いました。その結果、この状態においてもHLA-B*57:01とアバカビルは十分に結合していることを発見し、細胞内、特に小胞体内で既にHLAと薬物は結合することが示唆されます(図3右)。さらに、アバカビルを曝露すると、HLA-B*57:01を発現するケラチノサイトにおいて、不良品タンパク質の生成に起因する細胞内応答も確認することができました。
以上から、ケラチノサイトの小胞体内でHLAと薬物の結合に起因した不良品タンパク質の生成に伴う細胞内応答が、T細胞の皮膚への浸潤を含めた免疫活性化のきっかけとなっており、薬疹発症の原因になっていることが示されました。
* 今後の展望
本研究の結果は、小胞体内のHLAに薬物が結合することを想定することが、薬疹の発症を考える上で重要であることを示しています。これまで、HLAを介した免疫応答は、細胞表面上でのT細胞との相互作用の観点から説明されてきました。本研究から、HLA依存的な免疫の活性化は細胞内から既に始まっていることがわかり、HLAの新たな免疫的意義を提唱しています(図4)。今後、このような免疫応答がなぜ皮膚組織でのみ起こるのかを明らかにし、重篤な副作用の予防や治療法の開発に向けた研究を進める計画です。
図4:新たに発見したHLAがもつ細胞内での免疫的機能

図4:新たに発見したHLAがもつ細胞内での免疫的機能
* 用語解説
注1)ヒト白血球抗原(HLA):
“自己”を特徴付ける細胞表面のタンパク質のこと。体内で自己と非自己を認識するための重要な免疫機構としてはたらく。侵入した異物(非自己)をT細胞に提示し、T細胞がこれを排除することで、自己の恒常性を維持している。HLA遺伝子には多くの種類が存在し、さらにそれぞれの遺伝子が数十種類の異なるタイプを持つ。HLAは免疫に関係が深く、多くの疾患の発症や副作用の発現のリスク因子であることが報告されている。
注2)ケラチノサイト:
表皮の大部分を占める細胞。全身の表面を覆い、外界からのバリア機能に貢献するだけでなく、免疫反応にも重要な役割を果たす。侵入してきた異物を感知し、サイトカインを放出して免疫応答のスイッチを入れる役割も持つ。
注3)サイトカイン:免疫を含む種々の細胞応答において重要な役割を果たす分泌タンパク質であり、細胞間で情報を伝達し、炎症や免疫反応を調節する役割を担っている。
注4)ケモカイン:免疫細胞の移動などに重要な役割を果たす分泌タンパク質であり、受容した細胞を特定の場所に誘引することで、免疫応答や炎症反応を調節する。
注5)小胞体ストレス:
小胞体は、細胞内小器官の一つであり、膜タンパク質や分泌タンパク質の合成・立体構造の構築の場として機能し、それらのタンパク質の品質管理を行っている。小胞体ストレスは、小胞体に異常が生じた際に起こる現象であり、様々なシグナル伝達経路が活性化される。細胞が外部からのストレスや異常な状況にさらされると、小胞体でのタンパク質合成のプロセスが乱れることがあり、小胞体ストレスが引き起こされる。小胞体ストレスが長期間続くと、細胞の生存や機能に影響を及ぼし、さまざまな疾患や病態に関連することが知られている。
注6)ケミカルシャペロン:
タンパク質の正しい折りたたみや安定性を促進する化合物のこと。タンパク質の折りたたみの異常がいくつかの病態に関係していることが示唆されており、その異常をケミカルシャペロンを用いて解消することで、治療・予防に貢献できる可能性も期待されている。
* 研究プロジェクトについて
本研究は、日本学術振興会科学研究費助成事業(15H04661、15K14995、16K18932、17J03861、19H03386、21H02640、22J12718、23H02644、23H04764)の支援を受けて行われました。
* 論文情報
タイトル:HLA-B*57:01-dependent intracellular stress in keratinocytes triggers dermal
hypersensitivity reactions to abacavir
著者:Akira Kazaoka, Sota Fujimori, Yushiro Yamada, Tomohiro Shirayanagi, Yuying
Gao, Saki Kuwahara, Naoki Sakamoto, Takeshi Susukida, Shigeki Aoki, and Kousei
Ito
雑誌名:PNAS Nexus
DOI:



ディスカッション
コメント一覧
まだ、コメントがありません