ヒト造血幹細胞による幹細胞制御機構の分子メカニズムが明らかに 難治性血液疾患の発症機序の解明へ期待
トロント大学のAlex Murison博士、 John E. Dick教授、 Mathieu Lupien教授らの研究グループは、
臍帯血由来のヒト造血幹・前駆細胞のクロマチン(注1)状態の変化に着目し、 ヒト造血幹細胞による幹細胞制御機構の分子メカニズムを明らかにしました。
メカニズムが明らかになったことにより、 幹細胞制御機構の破綻で生じる白血病などの難治性血液疾患(注2)の発症機序の解明にも貢献することが期待されます。
本研究成果は、 2021年3月4日、 米国の国際医科学雑誌『Cell Stem Cell』に公開されました。 * 研究の背景
組織幹細胞は、 各組織に存在する非常に稀な細胞集団で、 自分自身と同じ能力をもつ細胞を生み出す「自己複製能」と、
その組織の全ての分化細胞を生み出す「多分化能」を保持し、 高い再生能力を発揮することで、 生涯にわたり組織の恒常性(注3)維持に重要な役割を果たしています。
組織幹細胞の中でも、 血液の生成を司る造血幹細胞(HSC)は最も研究が進んでいる幹細胞の一つです。
造血幹細胞には少なくとも2つの集団があり、
移植後長期間に渡り骨髄再構築能(注4)を示す長期造血幹細胞(LT-HSC)と1ヶ月程度の短期間のみ血液を生成する短期造血幹細胞(ST-HSC)に分けられます。
長期造血幹細胞と短期造血幹細胞の機能的な違いについては、 自己複製能に関連する静止期の長さや代謝、 DNA損傷への応答、
アポトーシス(注5)への反応性などが報告されてきましたが、 どのような分子メカニズムによりこれらの能力の違いが生み出されるのかは不明でした。
これまでに研究チームは、 網羅的な遺伝子発現解析を行ないましたが、 ヒト長期造血幹細胞と短期造血幹細胞の間には明確な遺伝子発現の違いは得られませんでした。
そこで研究チームは、 静止期の造血幹細胞にこそ遺伝子発現解析では捉えられない重要な幹細胞の生命原理があると考え、
ヒト造血幹細胞における自己複製能の制御メカニズムを解明するために、
活性化のみならずその準備段階のゲノム領域を捉えることが可能であるエピゲノム(注6)解析を用いて研究を行いました。 * 研究成果
研究チームは、 ヒト臍帯血由来の血液細胞から長期造血幹細胞、 短期造血幹細胞、 4種の造血前駆細胞、
7種の成熟血液細胞(注7)を取り出して複合オミックス解析(注8)を行い、 細胞の性質を解析しました。 その結果、
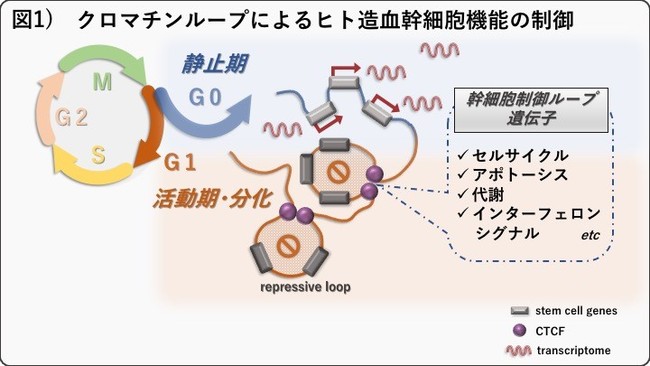
これまで報告されてきた造血幹細胞の幹細胞制御機構が、 クロマチンの3次元構造変化という一つの機構で制御されていることが明らかになりました。 また、
この機構の制御にはCCCTC結合因子(CTCF)(注9)がゲートキーパーのような役割を果たしていることが分かりました。 (詳説参照) * 今後の展開
本研究では、 これまで報告されてきた造血幹細胞の幹細胞制御機構が、 クロマチンの3次元構造変化という一つの機構で制御されていることが明らかになりました。
自己複製能の異常活性化は、 白血病などの血液のがんに繋がることが知られています。 実際、 他のクロマチンループ制御因子であるコヒーシン(注10)の変異が、
白血病をはじめとする多くの血液のがんで見つかっています。 CTCF自体の変異は白血病での報告は比較的まれですが、
CTCFの結合部位のエピゲノム状態の異常によりCTCFが正常に機能しなくなってしまう事が、 血液や脳など複数のがんの発症要因として疑われています。
研究グループでは、 血液がんの細胞でも同様の解析を行なっており、 疾患とクロマチン状態の変性についても研究を進め、 創薬開発を目指しています。 * 詳説
研究チームはヒト臍帯血由来血液細胞を最新の表面抗原とフローサイトメーター(注11)により、 長期造血幹細胞、 短期造血幹細胞、 4種の造血前駆細胞、
7種の成熟血液細胞を純化して、 複合オミックス解析を行いました。 オープンクロマチン(注12)解析、 遺伝子発現解析、 クロマチン免疫沈降法、
クロマチンコンフォメーションキャプチャー法(注13)を駆使し、 ヒト造血幹細胞における自己複製制御機構の解明を目指しました。
以下の1.~3.より、 CTCFは転写抑制型のクロマチンループ形成により、 複数の幹細胞制御遺伝子群の発現を抑制することで、
静止期を離脱するためのゲートキーパー的な遺伝子であることを明らかにしました。
1.オープンクロマチン状態の違いから見出したヒト造血幹細胞の早期分化段階でのCTCFの関与

ヒト造血幹・前駆細胞集団には大きく分けて2つのパターンのオープンクロマチン領域(シグネチャー)が同定されました。 一方は、
造血幹細胞から徐々にクロマチンが開いていく領域(ACT/HSPCシグネチャー)と、
徐々に閉じていく領域(LT/HSPCシグネチャー)とに分けられました(図2A,B,C,D)。 Act/HSPCシグネチャーに着目して見ると、
CCCTC結合因子(CTCF)のシークエンスが濃縮されていました。 CTCFの結合領域は、 短期造血幹細胞で最も開き、
骨髄球系前駆細胞(CMP,GMP)ではオープンクロマチン状態が維持されるのに対し、 リンパ球系では閉じていくことが明らかになりました(図2C,E)。
2.造血幹細胞分化開始のゲートキーパーとしてのCTCFの機能
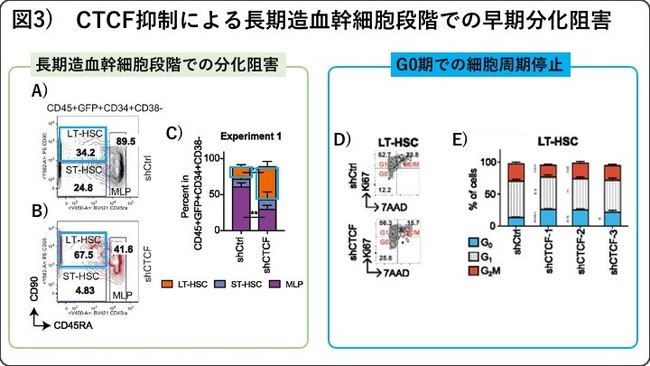
次に、 shRNA法でのCTCFノックダウン(mRNAの発現を抑制して機能を下げる手法)を行い、 免疫不全マウスへの移植実験による骨髄再構築能を評価しました。
その結果、 CTCFをノックダウンすると長期造血幹細胞段階での早期の分化阻害が確認されました(図3A-C)。 つまり、
CTCFは長期造血幹細胞の最初の分化の第一歩を踏み出すために必要なゲートキーパー因子であることが明らになりました。
3.クロマチンループによる幹細胞制御機構の抑制と静止期離脱
さらに、 CTCF抗体を用いた免疫沈降(CTCF-ChIP)解析、 クロマチンコンフォーメーションキャプチャー解析(Hi-C法)、
およびRNAシークエンス解析で詳細に調べたところ、
長期造血幹細胞から短期造血幹細胞へと分化に伴い開いていく領域では351個のCTCFが結合するクロマチンループが同定され、
そのループ内には412個の遺伝子が内包されていました。 これらのループ内の遺伝子のほとんどが、 長期造血幹細胞から短期造血幹細胞の分化に伴い、
発現が抑制されることから、 同定した351個のCTCFループは転写抑制に働くクロマチンループであることが分かりました。 またこれらのループに内包される遺伝子は、
従来報告されてきた幹細胞制御経路である、 セルサイクル、 アポトーシス、 代謝、 インターフェロンシグナルなどに関連する遺伝子であることがわかりました(図1)。
実際、 CTCFをノックダウンし、 細胞周期を解析したところ、 長期造血幹細胞のみでG0期からG1期へのセルサイクルの進行が阻害され、
これらの幹細胞制御経路の機能的な裏付けが示されました(図3D-E)。 * 論文情報
タイトル:“The Transition from Quiescent to Activated States in Human Hematopoietic
Stem Cells Is Governed by Dynamic 3D Genome Reorganization”
ゲノム3次元構造リモデリングによるヒト造血幹細胞の静止期制御機構の解明
著者:Takayama N, Murison A, Takayanagi SI, Arlidge C, Zhou S, Garcia-Prat L,
Chan-Seng-Yue M, Zandi S, Gan OI, Boutzen H, Kaufmann KB, Trotman-Grant A,
Schoof E, Kron K, Díaz N, Lee JJY, Medina T, De Carvalho DD, Taylor MD,
Vaquerizas JM, Xie SZ, Dick JE, Lupien M.
DOI:
https://doi.org/10.1016/j.stem.2020.11.001 * 研究プロジェクトについて
本研究は、 日本学術振興会 科学研究費助成事業 基盤研究Cの支援のもと行われました。 * 用語解説
(注1)クロマチン:真核生物の細胞内にあるDNAとタンパク質の複合体であり、 DNAを細胞核にコンパクトにまとめる機能や遺伝子発現を制御する機能を有する。
(注2)難治性血液疾患:白血病やリンパ腫、 骨髄異形成症候群、 骨髄増殖性疾患、 再生不良性貧血などの治療抵抗性な血液疾患。
(注3)恒常性:生物の持つ重要な生命維持機構の一つで、 生体内外の変化に関わらず、 生体の状態を一定に保つこと。 恒常性の破綻により、 老化や疾患へと導かれる。
(注4)骨髄再構築能:移植した造血幹細胞が、 レシピエント動物体内で、 血液系を再構築する能力。
(注5)アポトーシス:組織の恒常性を維持するために積極的に行われる細胞の自殺プログラム。
(注6)エピゲノム:DNAの塩基配列をゲノムと呼ぶことに対して、 そのゲノムに加えられた化学的修飾をエピゲノムと呼ぶ。 DNAメチル化、
ヒストンタンパク質のメチル化、 アセチル化、 リン酸化などの修飾が知られている。 ほとんど全ての細胞でゲノム情報は同一であるのにも関わらず、 神経細胞、
血液細胞、 皮膚細胞と、 それぞれ形も機能も異なる細胞の性質を保持しているのは、 エピゲノムにより特徴づけられているからである。
(注7)造血前駆細胞、 成熟血液細胞:造血前駆細胞は、 中間段階の細胞であり、 限定した系列(例えば骨髄球系、 リンパ球系など)の細胞へ分化能力のみを有し、
また自己複製能力はない。 造血幹細胞と造血前駆細胞とは、 自己複製能力の違い以外にも、 DNA損傷に対する応答、 ERストレス反応、 代謝、
細胞周期など様々な機能的な違いが報告されている。 成熟血液細胞とは、 T細胞、 B細胞、 顆粒球、 巨核球、 赤血球など終末分化した血液細胞であり、
特有の細胞機能を発揮し、 個体の免疫、 酸素運搬、 止血など様々な生理的機能を担っている。
(注8)複合オミックス解析:超高速にゲノム配列を読むことが可能な次世代シークエンス技術を用いて、 細胞内分子を網羅的に調べる解析をオミックス解析という。
対象が遺伝子DNAの場合は、 ゲノミクス、 メッセンジャーRNAの場合はトランスクリプトミクス、 エピゲノムの場合はエピゲノミクス、
タンパクの場合はプロテオミクスと呼ぶ。 複合オミックス解析は、 これら複数のオミックス解析を組み合わせて統合的に細胞の性質を理解するための手法である。
(注9)CCCTC結合因子(CTCF):Zinc fingerタンパクであり、
主にクロマチンループの形成やゲノムの活性化領域と不活性化領域の境界形成などのクロマチンの3次元構造調節を通じて、 転写調節、
インスレーター(絶縁体)活性などを担う転写因子。 DNAは幾重にも折り畳まれて、 発現すべき領域、 発現が抑制されるべき領域が、
ゲノムの3次元構造で厳密に制御されている。 発現すべき領域ではエンハンサーとその標的遺伝子のプロモーターが同一空間内に閉じ込められ、
物理的に近接することで発現すると考えられているが、 一方で、 エンハンサーが標的外のプロモーターを活性化しないように、
発現が抑制されるべき領域との境目にCTCFやコヒーシンタンパク質が結合することで、 絶縁体としての効果を担っている。
(注10)コヒーシン:SMC1, SMC3, kleisin, HEATの4つのサブユニットからなる複合体。 細胞分裂時の姉妹染色体の接着や、 転写制御を担う。
染色体上の局在部位の8-9割でCTCFと共局在し、 CTCFと共に、 上述するクロマチン構造の制御を通じて、 転写制御を行う。
(注11)フローサイトメーター:蛍光標識した特異性の高い抗体により、 細胞を標識し、 個々の細胞を光学的に識別する解析手法。
(注12) オープンクロマチン:ヌクレオソームにまきついていないゲノム領域であり、
活性化状態または活性化準備段階のプロモーターやエンハンサーといった遺伝子発現制御領域を含む。 一方、 閉じているクロマチン領域では、
その領域の遺伝子発現は強く抑制されている。
(注13)クロマチンコンフォメーションキャプチャー法:ホルムアルデヒド架橋によりクロマチンの3次元構造を固定後、 制限酵素による切断し、 ライゲーション反応、
シークエンス技術などで、 離れたゲノム領域間の物理的相互作用を明らかにする手法。





ディスカッション
コメント一覧
まだ、コメントがありません